摘要:在急性髓性白血病(AML)細胞表面發(fā)現(xiàn)了一種易于藥物治療的靶點——在多個體內(nèi)模型中,單克隆抗體抑制了白血病,沒有明顯的副作用。
2021年,由Ryan Flynn醫(yī)學博士和他的導(dǎo)師、諾貝爾獎得主Carolyn Bertozzi博士領(lǐng)導(dǎo)的研究,揭開了生物學的新篇章,描繪了細胞表面上一種新的參與者:glycoRNAs。最近在《細胞》雜志上,F(xiàn)lynn和他的同事們擴展了這一發(fā)現(xiàn),他們發(fā)現(xiàn)糖RNA在細胞表面與RNA結(jié)合蛋白形成高度組織化的簇。這些簇似乎調(diào)節(jié)細胞與環(huán)境之間的通訊。
現(xiàn)在,在《自然生物技術(shù)》雜志上,弗林在波士頓兒童醫(yī)院和丹娜-法伯/波士頓兒童癌癥和血液疾病中心的干細胞項目團隊展示了這種新發(fā)現(xiàn)的生物學的第一個應(yīng)用:對抗癌癥。
 圖1 通過靶向細胞表面RNA結(jié)合蛋白治療急性髓系白血病模型
圖1 通過靶向細胞表面RNA結(jié)合蛋白治療急性髓系白血病模型由Konstantinos Tzelepis博士和Maria Eleftheriou博士領(lǐng)導(dǎo)的劍橋(英國)干細胞研究所的合作者表明,細胞表面的一種rna結(jié)合蛋白NPM1可能是治療急性髓性白血病(AML)和實體腫瘤的有效選擇性靶點。
靶向NPM1蛋白
AML是一種快速進展的血癌,由于其許多驅(qū)動途徑對非癌細胞(包括血液干細胞)也是必需的,因此很難靶向治療。弗林說:“這種疾病可能對現(xiàn)有的藥物不敏感,或者患者可能太虛弱而無法接受傳統(tǒng)的治療,因為毒性太高。”
他和他的同事將注意力集中在NPM1上,因為NPM1基因的突變與成人AML密切相關(guān)——大約60%的病例不是由染色體異常引起的。雖然NPM1通常存在于細胞內(nèi),但Flynn、Tzelepis及其同事發(fā)現(xiàn),在惡性AML細胞中,NPM1出現(xiàn)在細胞表面。
“與健康細胞相比,白血病細胞的細胞表面NPM1的數(shù)量高出十倍以上,”弗林說。“它在我們觀察的幾乎每個患者的細胞中都非常強烈地表達。癌癥和健康血液干細胞之間的差異超過100倍;正常的造血干細胞表面幾乎沒有NPM1。”
因為NPM1是一種表面標記物,所以用簡單的方法就可以很容易地檢測到,并且可以提供一種監(jiān)測患者的方法。但NPM1位于細胞表面的真正好處在于,它可以很容易地被廣泛使用的藥物(如抗體)靶向。
使用靶向NPM1的單克隆抗體,研究人員在多種AML體內(nèi)模型中發(fā)現(xiàn)了強大的抗腫瘤活性,而非癌性血細胞和干細胞則幸免。在四種不同的白血病小鼠模型中,抗體中和AML并延長生存期,沒有明顯的毒性。
最令人興奮的是,抗體有效地靶向骨髓樣本和小鼠模型中的白血病干細胞。弗林說:“這是至關(guān)重要的,因為少數(shù)白血病干細胞可以使癌癥再生,即使它看起來已經(jīng)被根除了。”
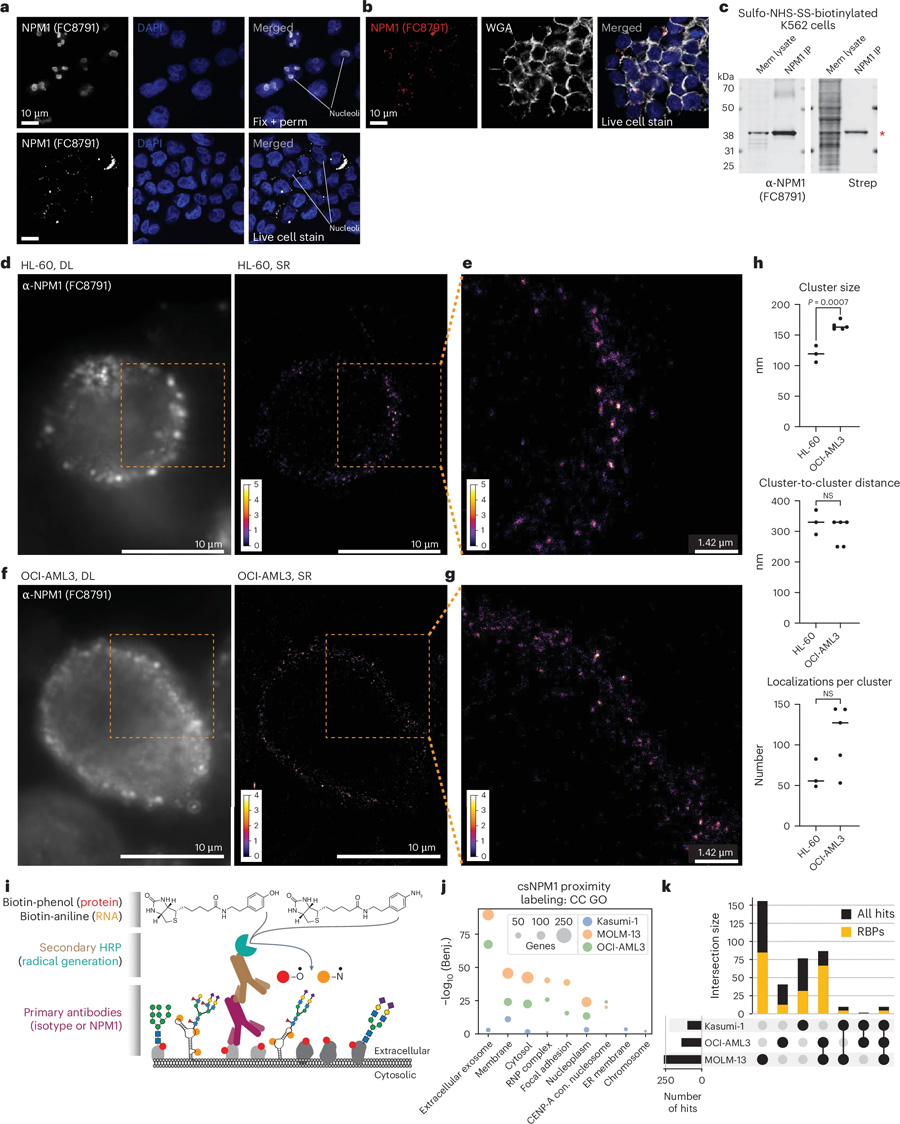
圖2 全長NPM1與其他RNA結(jié)合蛋白在細胞表面形成納米簇
其他癌癥呢?
靶向NPM1的潛在益處可能擴展到其他癌癥。該團隊測試了47個人類和小鼠實體瘤模型,發(fā)現(xiàn)大多數(shù)細胞表面都有不同程度的NPM1。小鼠實驗表明,靶向細胞表面NPM1的單克隆抗體可能對某些實體腫瘤有效,包括前列腺癌和結(jié)直腸癌。
弗林實驗室的醫(yī)學博士本森·喬治(Benson George)是這篇新論文的第一作者之一,他說:“尋找對惡性腫瘤特異性的細胞表面靶點,但對健康組織卻沒有影響,這是免疫腫瘤學長期追求的目標。”“許多癌癥缺乏已知的分子手柄,可以安全地利用這些手柄向免疫系統(tǒng)發(fā)出攻擊信號。結(jié)腸直腸癌就是一個很好的例子,它的發(fā)病率正在上升。”
劍橋(英國)干細胞研究所的合作者Konstantinos Tzelepis說:“新型癌癥療法的發(fā)展在很大程度上取決于新的癌癥生物學的發(fā)現(xiàn)。”“我很高興我們的合作發(fā)現(xiàn)了一種有前途的生物技術(shù)方法,可以針對未滿足醫(yī)療需求的癌癥。我們的目標是更好地理解并加速將這些新抗原轉(zhuǎn)化為新的有效治療方法。”
在未來的工作中,研究小組計劃研究為什么細胞會將NPM1帶到表面,并探索glycoRNA和rna結(jié)合蛋白簇是否含有其他與癌癥相關(guān)的靶向分子。
“我們假設(shè)將NPM1帶到細胞表面在某種程度上對腫瘤有益,這確實是一類新的腫瘤抗原。”
參考資料
[1] Treatment of acute myeloid leukemia models by targeting a cell surface RNA-binding protein
摘要:在急性髓性白血病(AML)細胞表面發(fā)現(xiàn)了一種易于藥物治療的靶點——在多個體內(nèi)模型中,單克隆抗體抑制了白血病,沒有明顯的副作用。
2021年,由Ryan Flynn醫(yī)學博士和他的導(dǎo)師、諾貝爾獎得主Carolyn Bertozzi博士領(lǐng)導(dǎo)的研究,揭開了生物學的新篇章,描繪了細胞表面上一種新的參與者:glycoRNAs。最近在《細胞》雜志上,F(xiàn)lynn和他的同事們擴展了這一發(fā)現(xiàn),他們發(fā)現(xiàn)糖RNA在細胞表面與RNA結(jié)合蛋白形成高度組織化的簇。這些簇似乎調(diào)節(jié)細胞與環(huán)境之間的通訊。
現(xiàn)在,在《自然生物技術(shù)》雜志上,弗林在波士頓兒童醫(yī)院和丹娜-法伯/波士頓兒童癌癥和血液疾病中心的干細胞項目團隊展示了這種新發(fā)現(xiàn)的生物學的第一個應(yīng)用:對抗癌癥。
 圖1 通過靶向細胞表面RNA結(jié)合蛋白治療急性髓系白血病模型
圖1 通過靶向細胞表面RNA結(jié)合蛋白治療急性髓系白血病模型由Konstantinos Tzelepis博士和Maria Eleftheriou博士領(lǐng)導(dǎo)的劍橋(英國)干細胞研究所的合作者表明,細胞表面的一種rna結(jié)合蛋白NPM1可能是治療急性髓性白血病(AML)和實體腫瘤的有效選擇性靶點。
靶向NPM1蛋白
AML是一種快速進展的血癌,由于其許多驅(qū)動途徑對非癌細胞(包括血液干細胞)也是必需的,因此很難靶向治療。弗林說:“這種疾病可能對現(xiàn)有的藥物不敏感,或者患者可能太虛弱而無法接受傳統(tǒng)的治療,因為毒性太高。”
他和他的同事將注意力集中在NPM1上,因為NPM1基因的突變與成人AML密切相關(guān)——大約60%的病例不是由染色體異常引起的。雖然NPM1通常存在于細胞內(nèi),但Flynn、Tzelepis及其同事發(fā)現(xiàn),在惡性AML細胞中,NPM1出現(xiàn)在細胞表面。
“與健康細胞相比,白血病細胞的細胞表面NPM1的數(shù)量高出十倍以上,”弗林說。“它在我們觀察的幾乎每個患者的細胞中都非常強烈地表達。癌癥和健康血液干細胞之間的差異超過100倍;正常的造血干細胞表面幾乎沒有NPM1。”
因為NPM1是一種表面標記物,所以用簡單的方法就可以很容易地檢測到,并且可以提供一種監(jiān)測患者的方法。但NPM1位于細胞表面的真正好處在于,它可以很容易地被廣泛使用的藥物(如抗體)靶向。
使用靶向NPM1的單克隆抗體,研究人員在多種AML體內(nèi)模型中發(fā)現(xiàn)了強大的抗腫瘤活性,而非癌性血細胞和干細胞則幸免。在四種不同的白血病小鼠模型中,抗體中和AML并延長生存期,沒有明顯的毒性。
最令人興奮的是,抗體有效地靶向骨髓樣本和小鼠模型中的白血病干細胞。弗林說:“這是至關(guān)重要的,因為少數(shù)白血病干細胞可以使癌癥再生,即使它看起來已經(jīng)被根除了。”

圖2 全長NPM1與其他RNA結(jié)合蛋白在細胞表面形成納米簇
其他癌癥呢?
靶向NPM1的潛在益處可能擴展到其他癌癥。該團隊測試了47個人類和小鼠實體瘤模型,發(fā)現(xiàn)大多數(shù)細胞表面都有不同程度的NPM1。小鼠實驗表明,靶向細胞表面NPM1的單克隆抗體可能對某些實體腫瘤有效,包括前列腺癌和結(jié)直腸癌。
弗林實驗室的醫(yī)學博士本森·喬治(Benson George)是這篇新論文的第一作者之一,他說:“尋找對惡性腫瘤特異性的細胞表面靶點,但對健康組織卻沒有影響,這是免疫腫瘤學長期追求的目標。”“許多癌癥缺乏已知的分子手柄,可以安全地利用這些手柄向免疫系統(tǒng)發(fā)出攻擊信號。結(jié)腸直腸癌就是一個很好的例子,它的發(fā)病率正在上升。”
劍橋(英國)干細胞研究所的合作者Konstantinos Tzelepis說:“新型癌癥療法的發(fā)展在很大程度上取決于新的癌癥生物學的發(fā)現(xiàn)。”“我很高興我們的合作發(fā)現(xiàn)了一種有前途的生物技術(shù)方法,可以針對未滿足醫(yī)療需求的癌癥。我們的目標是更好地理解并加速將這些新抗原轉(zhuǎn)化為新的有效治療方法。”
在未來的工作中,研究小組計劃研究為什么細胞會將NPM1帶到表面,并探索glycoRNA和rna結(jié)合蛋白簇是否含有其他與癌癥相關(guān)的靶向分子。
“我們假設(shè)將NPM1帶到細胞表面在某種程度上對腫瘤有益,這確實是一類新的腫瘤抗原。”
參考資料
[1] Treatment of acute myeloid leukemia models by targeting a cell surface RNA-binding protein



