摘要:根據一項新的研究,研究人員設計了抗癌納米顆粒,可以同時傳遞化療藥物和一種新的免疫療法。
新的免疫治療方法使研究人員發現的與免疫抑制有關的基因沉默。當與現有的化療藥物結合并包裝成微小的納米顆粒時,這種療法縮小了結腸癌和胰腺癌小鼠模型中的腫瘤。
“我們的研究有兩個創新的方面:發現了一種新的治療靶點和一種新的納米載體,它在免疫治療和化療藥物的選擇性傳遞中非常有效,”皮特藥學院藥學教授、UPMC希爾曼癌癥中心研究員、高級作者Song Li說。“我對這項研究感到興奮,因為它具有高度的轉譯性。我們還不知道我們的方法是否對患者有效,但我們的研究結果表明,有很大的潛力。”
化療是癌癥治療的支柱,但殘留的癌細胞會持續存在并導致腫瘤復發。這個過程涉及到一種叫做磷脂酰絲氨酸(PS)的脂質,這種脂質通常存在于腫瘤細胞膜的內層,但在化療藥物的作用下會遷移到細胞表面。在表面上,PS起到免疫抑制劑的作用,保護剩余的癌細胞免受免疫系統的傷害。
皮特大學的研究人員發現,化療藥物氟尿嘧啶和奧鉑(FuOXP)的治療導致Xkr8水平升高,Xkr8是一種控制細胞膜上PS分布的蛋白質。這一發現表明,阻斷Xkr8可以阻止癌細胞將PS分流到細胞表面,從而允許免疫細胞清除化療后殘留的癌細胞。
在最近發表在《細胞報告》上的一項獨立研究中,皮特大學免疫學助理教授Yi-Nan Gong博士也將Xkr8確定為一種新的治療靶點,以促進抗腫瘤免疫反應。

圖1 科學家將Xkr8確定為一種新的治療靶點,以促進抗腫瘤免疫反應(圖源:[1])
這一團隊設計了一種被稱為短干擾RNA (siRNA)的遺傳密碼片段,它可以停止特定蛋白質的生產——在本例中是Xkr8。將siRNA和FuOXP打包成雙作用納米顆粒后,下一步是將它們靶向于腫瘤。
納米顆粒通常太大,無法穿過健康組織中完整的血管,但它們可以到達癌細胞,因為腫瘤有時血管發育不良,有小孔,允許它們通過。但是這種靶向腫瘤的方法是有限的,因為許多人類腫瘤沒有足夠大的孔讓納米顆粒通過。
“就像渡船載著人們從河的一邊到另一邊,我們想開發一種機制,讓納米顆粒不依賴于孔穿過完整的血管,”Li說。
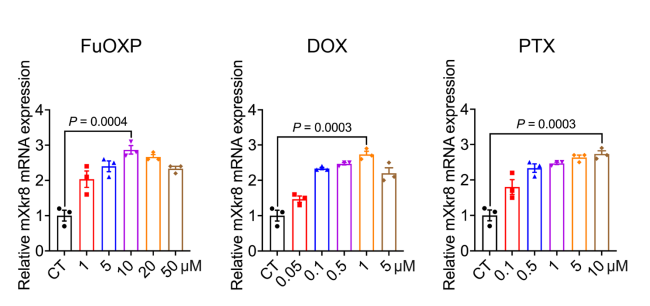
圖2 不同化療藥物對Xkr8的誘導作用(圖源:[1])
為了開發這樣的渡輪,研究人員用硫酸軟骨素和聚乙二醇裝飾納米顆粒的表面。這些化合物通過與腫瘤血管和腫瘤細胞上常見的細胞受體結合,延長它們在血流中的停留時間,幫助納米顆粒靶向腫瘤,避開健康組織。
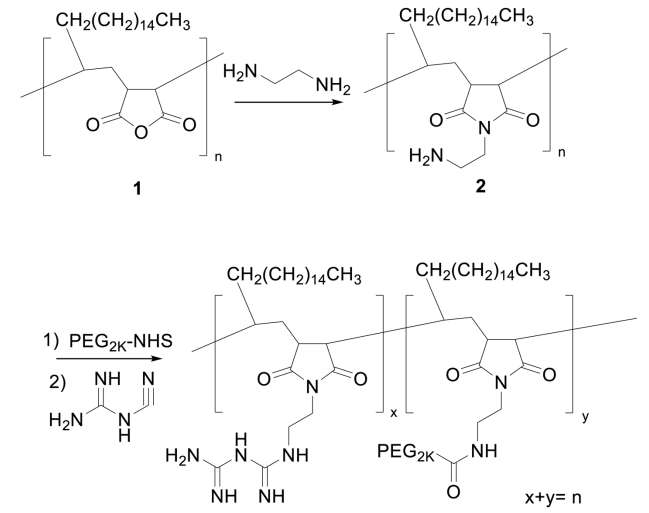
圖3 PMBOP聚合物的合成方案(圖源:[1])
當注射到小鼠體內時,大約10%的納米顆粒會到達小鼠的腫瘤,這比大多數其他納米載體平臺都有顯著改進。此前一項對已發表研究的分析發現,平均而言,只有0.7%的納米顆粒劑量達到了目標。
與單獨含有化學藥物FuOXP的納米顆粒相比,雙作用納米顆粒顯著減少了免疫抑制PS向細胞表面的遷移。
接下來,研究人員在結腸癌和胰腺癌小鼠模型中測試了他們的平臺。與接受安慰劑或FuOXP劑量的動物相比,接受含有FuOXP和siRNA的納米顆粒治療的動物具有更好的腫瘤微環境,有更多的抗癌T細胞和較少的免疫抑制調節性T細胞。
結果,與只接受一種治療的小鼠相比,接受siRNA-FuOXP納米顆粒的小鼠腫瘤大小顯著減小。

圖4 PMBOP-CP NPs 214針對不同腫瘤模型的體內腫瘤靶向效率比較(圖源:[1])
Li表示,該研究還指出了將FuOXP-siRNA納米顆粒與另一種名為檢查點抑制劑的免疫療法結合的潛力。PD-1等免疫檢查點就像免疫系統的剎車,但檢查點抑制劑的作用是釋放剎車,幫助免疫細胞對抗癌癥。
研究人員發現,含siRNA或不含siRNA的FuOXP納米顆粒增加了PD-1的表達。但當他們加入PD-1抑制劑藥物時,這種聯合療法在小鼠體內的腫瘤生長和存活方面有顯著改善。
他們的目標是將他們的新療法轉化為臨床,該團隊現在正在通過更多的實驗來驗證他們的發現,并進一步評估潛在的副作用。
參考資料:
[1] Targeting Xkr8 via nanoparticle-mediated in situ co-delivery of siRNA and chemotherapy drugs for cancer immunochemotherapy
摘要:根據一項新的研究,研究人員設計了抗癌納米顆粒,可以同時傳遞化療藥物和一種新的免疫療法。
新的免疫治療方法使研究人員發現的與免疫抑制有關的基因沉默。當與現有的化療藥物結合并包裝成微小的納米顆粒時,這種療法縮小了結腸癌和胰腺癌小鼠模型中的腫瘤。
“我們的研究有兩個創新的方面:發現了一種新的治療靶點和一種新的納米載體,它在免疫治療和化療藥物的選擇性傳遞中非常有效,”皮特藥學院藥學教授、UPMC希爾曼癌癥中心研究員、高級作者Song Li說。“我對這項研究感到興奮,因為它具有高度的轉譯性。我們還不知道我們的方法是否對患者有效,但我們的研究結果表明,有很大的潛力。”
化療是癌癥治療的支柱,但殘留的癌細胞會持續存在并導致腫瘤復發。這個過程涉及到一種叫做磷脂酰絲氨酸(PS)的脂質,這種脂質通常存在于腫瘤細胞膜的內層,但在化療藥物的作用下會遷移到細胞表面。在表面上,PS起到免疫抑制劑的作用,保護剩余的癌細胞免受免疫系統的傷害。
皮特大學的研究人員發現,化療藥物氟尿嘧啶和奧鉑(FuOXP)的治療導致Xkr8水平升高,Xkr8是一種控制細胞膜上PS分布的蛋白質。這一發現表明,阻斷Xkr8可以阻止癌細胞將PS分流到細胞表面,從而允許免疫細胞清除化療后殘留的癌細胞。
在最近發表在《細胞報告》上的一項獨立研究中,皮特大學免疫學助理教授Yi-Nan Gong博士也將Xkr8確定為一種新的治療靶點,以促進抗腫瘤免疫反應。

圖1 科學家將Xkr8確定為一種新的治療靶點,以促進抗腫瘤免疫反應(圖源:[1])
這一團隊設計了一種被稱為短干擾RNA (siRNA)的遺傳密碼片段,它可以停止特定蛋白質的生產——在本例中是Xkr8。將siRNA和FuOXP打包成雙作用納米顆粒后,下一步是將它們靶向于腫瘤。
納米顆粒通常太大,無法穿過健康組織中完整的血管,但它們可以到達癌細胞,因為腫瘤有時血管發育不良,有小孔,允許它們通過。但是這種靶向腫瘤的方法是有限的,因為許多人類腫瘤沒有足夠大的孔讓納米顆粒通過。
“就像渡船載著人們從河的一邊到另一邊,我們想開發一種機制,讓納米顆粒不依賴于孔穿過完整的血管,”Li說。

圖2 不同化療藥物對Xkr8的誘導作用(圖源:[1])
為了開發這樣的渡輪,研究人員用硫酸軟骨素和聚乙二醇裝飾納米顆粒的表面。這些化合物通過與腫瘤血管和腫瘤細胞上常見的細胞受體結合,延長它們在血流中的停留時間,幫助納米顆粒靶向腫瘤,避開健康組織。

圖3 PMBOP聚合物的合成方案(圖源:[1])
當注射到小鼠體內時,大約10%的納米顆粒會到達小鼠的腫瘤,這比大多數其他納米載體平臺都有顯著改進。此前一項對已發表研究的分析發現,平均而言,只有0.7%的納米顆粒劑量達到了目標。
與單獨含有化學藥物FuOXP的納米顆粒相比,雙作用納米顆粒顯著減少了免疫抑制PS向細胞表面的遷移。
接下來,研究人員在結腸癌和胰腺癌小鼠模型中測試了他們的平臺。與接受安慰劑或FuOXP劑量的動物相比,接受含有FuOXP和siRNA的納米顆粒治療的動物具有更好的腫瘤微環境,有更多的抗癌T細胞和較少的免疫抑制調節性T細胞。
結果,與只接受一種治療的小鼠相比,接受siRNA-FuOXP納米顆粒的小鼠腫瘤大小顯著減小。

圖4 PMBOP-CP NPs 214針對不同腫瘤模型的體內腫瘤靶向效率比較(圖源:[1])
Li表示,該研究還指出了將FuOXP-siRNA納米顆粒與另一種名為檢查點抑制劑的免疫療法結合的潛力。PD-1等免疫檢查點就像免疫系統的剎車,但檢查點抑制劑的作用是釋放剎車,幫助免疫細胞對抗癌癥。
研究人員發現,含siRNA或不含siRNA的FuOXP納米顆粒增加了PD-1的表達。但當他們加入PD-1抑制劑藥物時,這種聯合療法在小鼠體內的腫瘤生長和存活方面有顯著改善。
他們的目標是將他們的新療法轉化為臨床,該團隊現在正在通過更多的實驗來驗證他們的發現,并進一步評估潛在的副作用。
參考資料:
[1] Targeting Xkr8 via nanoparticle-mediated in situ co-delivery of siRNA and chemotherapy drugs for cancer immunochemotherapy



