摘要:研究結果表明,癌癥中的許多突變可能只是將腫瘤干細胞與其周圍環境的異常對話所形成的路徑固定了。
是什么驅動了腫瘤的生長?是少數流氓細胞將自己的意志強加于健康組織,還是病變組織將原本平靜的細胞中最壞的東西帶了出來?或者這是一種來回的,兩者之間的對話?根據一項新的研究,至少就一種常見皮膚癌的發展而言,可能是后者。
研究人員發現,在原本健康的干細胞中,一個突變的基因會引發惡性干細胞與其周圍組織之間日益偏離的錯誤溝通反饋循環,加速惡性腫瘤的發展。研究結果表明,癌癥中的許多突變可能只是將腫瘤干細胞與其周圍環境的異常對話所形成的路徑固定了。如果這些發表在《自然》雜志上的結果被證明廣泛適用,那么這些發現可能為治療一系列癌癥的新方法鋪平道路。

圖1 突變的基因會引發惡性干細胞與其周圍組織之間日益偏離的錯誤溝通反饋循環(圖源:[1])
“這不僅僅是癌癥塑造了微環境,或者環境影響了腫瘤,”第一作Shaopeng Yuan說,“我們的研究表明,微環境和腫瘤中的干細胞之間存在串擾。它們相互交流,創造了一個腫瘤促進因子的循環。”
聚焦鱗狀細胞癌
幾乎每一個腫瘤的中心都有一小部分癌癥干細胞。這些惡性種子對化療和免疫療法具有耐藥性,它們是負責維持腫瘤存活的細胞,也是將良性腫瘤轉變為轉移性疾病過程中的關鍵角色。在包括皮膚癌、胰腺癌、肺癌和結直腸癌在內的許多癌癥干細胞背后,都有一個RAS基因,當該基因發生突變時,組織干細胞會忽略正常的環境信號,偏離其自然進程,促進組織生長失控。
為了更好地理解這種相互作用的細節,Yuan和同事們將注意力轉向了鱗狀細胞癌,一種與RAS突變相關的皮膚癌。研究小組首先在單個皮膚干細胞中誘導突變的HRAS (RAS家族中最常見的RAS家族成員),并監測癌變干細胞如何與周圍組織相互作用。“隨著時間的推移,癌癥干細胞和它的微環境之間的對話變得越來越異常,當我們破譯這些對話時,我們意識到,干細胞和它的微環境之間的錯誤交流導致了在相應的人類癌癥中活躍的相同通路的激活,這些癌癥具有很高的突變負擔。”
這一觀察提出了一種有趣的可能性。也許許多癌癥突變并沒有確定疾病的發展過程,而是將其鎖定在一定位置,確認了癌癥干細胞與其微環境之間異常的串擾已經確定的惡性進展。
瘦素信號的一個令人驚訝的作用
進一步研究癌癥干細胞在面對這種新的自我強加的惡性腫瘤微環境時是如何變化的,研究小組意識到侵襲性癌癥干細胞意外地開始表達瘦素受體:Lepr。瘦素是一種由脂肪細胞產生的激素,與肥胖有關,在攜帶非脂肪腫瘤的非肥胖小鼠體內似乎不合適。Lepr在正常上皮細胞中不表達,在良性腫瘤細胞中罕見。在這里,它意外地出現在晚期腫瘤的癌癥干細胞中,即鱗狀細胞癌(SCC)。

圖2 瘦素受體是一種TGFβ調節基因,在腫瘤起始的CSC中誘導并定位于侵襲性SCC前沿(圖源:[1])
Yuan使用CRISPR技術表明,Lepr和瘦素受體信號是良性向惡性發展的必要條件。但是瘦素是從哪里來的呢?沒有明顯的脂肪細胞增加來解釋瘦素,良性生長、晚期腫瘤細胞或腫瘤微環境似乎都沒有表達瘦素基因。然而,表達瘦素受體的惡性腫瘤極大地受益于瘦素的存在——瘦素越多,生長越快。
研究小組開始懷疑,正常情況下在血液中循環的瘦素是否通過將營養物質和其他因素帶到腫瘤的血管到達了腫瘤。通過一系列實驗,他們提供了令人信服的證據證明了這一點。此外,他們進一步證明,癌癥干細胞中的Lepr/leptin信號通路刺激了許多已知的在癌癥中高度激活的通路,包括pi3 -激酶、AKT和mTOR通路。綜上所述,研究人員揭示了單個致癌基因如何觸發干細胞與其環境之間的一系列自我延續的錯誤溝通,從而導致惡性腫瘤。
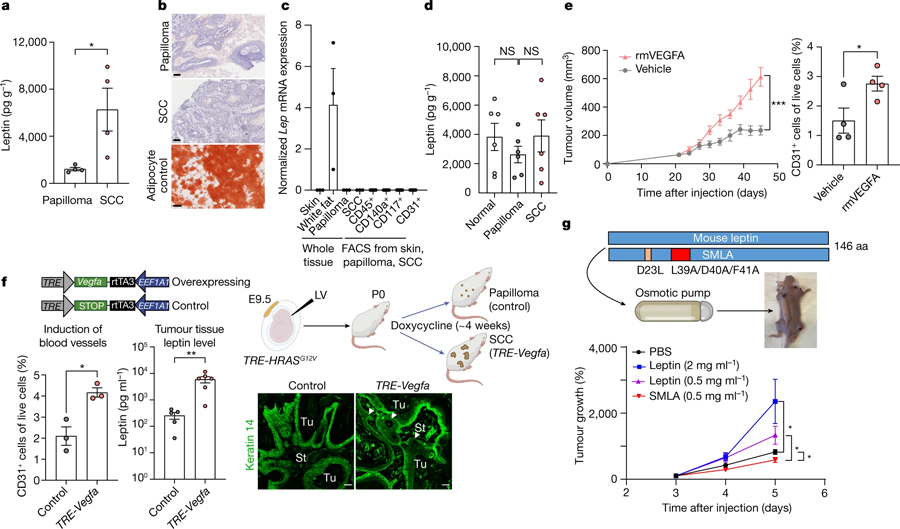
圖3 惡性腫瘤微環境中瘦素水平升高,是由血管生成增加引起的(圖源:[1])
該團隊目前正在研究阻斷腫瘤中瘦素受體的方法,因為這樣做可能會在惡性循環中拋出一個分子扳手,使癌癥脫軌。Yuan說:“癌癥干細胞和微環境之間的瘦素受體/瘦素串擾驅動了一個促進惡性腫瘤的正反饋循環。”“如果我們阻斷這個循環,它是驅動腫瘤發展的主要途徑,也許我們就能阻止腫瘤發展。”
鱗狀細胞癌不僅影響皮膚,還影響食道、頭頸、肺和其他上皮組織,是世界上第六大常見癌癥。但這些發現的意義不僅限于這種特定的癌癥。癌癥生物學家通常認為,驅動腫瘤進展的基因表達變化是細胞內許多累積突變的結果,但從干細胞生物學家的角度來看,這項工作表明,一個單一的致癌突變如何通過與腫瘤微環境的異常交換,獨立于后續突變,啟動推動癌癥發展的事件。
“我們的研究表明,一個致癌突變可以劫持一個通路,并實現與許多累積突變相同的效果,我們一直在尋找突變,但我們絕不能忘記思考如何停止驅動腫瘤生長的信號通路。”
參考資料:
[1] Ras drives malignancy through stem cell crosstalk with the microenvironment
摘要:研究結果表明,癌癥中的許多突變可能只是將腫瘤干細胞與其周圍環境的異常對話所形成的路徑固定了。
是什么驅動了腫瘤的生長?是少數流氓細胞將自己的意志強加于健康組織,還是病變組織將原本平靜的細胞中最壞的東西帶了出來?或者這是一種來回的,兩者之間的對話?根據一項新的研究,至少就一種常見皮膚癌的發展而言,可能是后者。
研究人員發現,在原本健康的干細胞中,一個突變的基因會引發惡性干細胞與其周圍組織之間日益偏離的錯誤溝通反饋循環,加速惡性腫瘤的發展。研究結果表明,癌癥中的許多突變可能只是將腫瘤干細胞與其周圍環境的異常對話所形成的路徑固定了。如果這些發表在《自然》雜志上的結果被證明廣泛適用,那么這些發現可能為治療一系列癌癥的新方法鋪平道路。

圖1 突變的基因會引發惡性干細胞與其周圍組織之間日益偏離的錯誤溝通反饋循環(圖源:[1])
“這不僅僅是癌癥塑造了微環境,或者環境影響了腫瘤,”第一作Shaopeng Yuan說,“我們的研究表明,微環境和腫瘤中的干細胞之間存在串擾。它們相互交流,創造了一個腫瘤促進因子的循環。”
聚焦鱗狀細胞癌
幾乎每一個腫瘤的中心都有一小部分癌癥干細胞。這些惡性種子對化療和免疫療法具有耐藥性,它們是負責維持腫瘤存活的細胞,也是將良性腫瘤轉變為轉移性疾病過程中的關鍵角色。在包括皮膚癌、胰腺癌、肺癌和結直腸癌在內的許多癌癥干細胞背后,都有一個RAS基因,當該基因發生突變時,組織干細胞會忽略正常的環境信號,偏離其自然進程,促進組織生長失控。
為了更好地理解這種相互作用的細節,Yuan和同事們將注意力轉向了鱗狀細胞癌,一種與RAS突變相關的皮膚癌。研究小組首先在單個皮膚干細胞中誘導突變的HRAS (RAS家族中最常見的RAS家族成員),并監測癌變干細胞如何與周圍組織相互作用。“隨著時間的推移,癌癥干細胞和它的微環境之間的對話變得越來越異常,當我們破譯這些對話時,我們意識到,干細胞和它的微環境之間的錯誤交流導致了在相應的人類癌癥中活躍的相同通路的激活,這些癌癥具有很高的突變負擔。”
這一觀察提出了一種有趣的可能性。也許許多癌癥突變并沒有確定疾病的發展過程,而是將其鎖定在一定位置,確認了癌癥干細胞與其微環境之間異常的串擾已經確定的惡性進展。
瘦素信號的一個令人驚訝的作用
進一步研究癌癥干細胞在面對這種新的自我強加的惡性腫瘤微環境時是如何變化的,研究小組意識到侵襲性癌癥干細胞意外地開始表達瘦素受體:Lepr。瘦素是一種由脂肪細胞產生的激素,與肥胖有關,在攜帶非脂肪腫瘤的非肥胖小鼠體內似乎不合適。Lepr在正常上皮細胞中不表達,在良性腫瘤細胞中罕見。在這里,它意外地出現在晚期腫瘤的癌癥干細胞中,即鱗狀細胞癌(SCC)。

圖2 瘦素受體是一種TGFβ調節基因,在腫瘤起始的CSC中誘導并定位于侵襲性SCC前沿(圖源:[1])
Yuan使用CRISPR技術表明,Lepr和瘦素受體信號是良性向惡性發展的必要條件。但是瘦素是從哪里來的呢?沒有明顯的脂肪細胞增加來解釋瘦素,良性生長、晚期腫瘤細胞或腫瘤微環境似乎都沒有表達瘦素基因。然而,表達瘦素受體的惡性腫瘤極大地受益于瘦素的存在——瘦素越多,生長越快。
研究小組開始懷疑,正常情況下在血液中循環的瘦素是否通過將營養物質和其他因素帶到腫瘤的血管到達了腫瘤。通過一系列實驗,他們提供了令人信服的證據證明了這一點。此外,他們進一步證明,癌癥干細胞中的Lepr/leptin信號通路刺激了許多已知的在癌癥中高度激活的通路,包括pi3 -激酶、AKT和mTOR通路。綜上所述,研究人員揭示了單個致癌基因如何觸發干細胞與其環境之間的一系列自我延續的錯誤溝通,從而導致惡性腫瘤。

圖3 惡性腫瘤微環境中瘦素水平升高,是由血管生成增加引起的(圖源:[1])
該團隊目前正在研究阻斷腫瘤中瘦素受體的方法,因為這樣做可能會在惡性循環中拋出一個分子扳手,使癌癥脫軌。Yuan說:“癌癥干細胞和微環境之間的瘦素受體/瘦素串擾驅動了一個促進惡性腫瘤的正反饋循環。”“如果我們阻斷這個循環,它是驅動腫瘤發展的主要途徑,也許我們就能阻止腫瘤發展。”
鱗狀細胞癌不僅影響皮膚,還影響食道、頭頸、肺和其他上皮組織,是世界上第六大常見癌癥。但這些發現的意義不僅限于這種特定的癌癥。癌癥生物學家通常認為,驅動腫瘤進展的基因表達變化是細胞內許多累積突變的結果,但從干細胞生物學家的角度來看,這項工作表明,一個單一的致癌突變如何通過與腫瘤微環境的異常交換,獨立于后續突變,啟動推動癌癥發展的事件。
“我們的研究表明,一個致癌突變可以劫持一個通路,并實現與許多累積突變相同的效果,我們一直在尋找突變,但我們絕不能忘記思考如何停止驅動腫瘤生長的信號通路。”
參考資料:
[1] Ras drives malignancy through stem cell crosstalk with the microenvironment



