摘要:研究人員發現了一種眾所周知的酶的新功能:信號肽酶復合體負責膜蛋白的質量控制。細胞生物學中一種關鍵酶的新功能的發現已經發表在《Science》雜志上,這可能會為阿爾茨海默癥和其他蛋白質錯誤折疊疾病帶來新的治療方法。
來自科隆、海德堡和慕尼黑的一個跨學科科學家團隊發現了一種著名酶的新功能:內質網中的信號肽酶復合體分裂有缺陷的膜蛋白,啟動它們的降解。在我們的細胞中,內質網負責產生和控制從細胞中分泌的蛋白質。信號肽酶復合體將這些多肽鏈切斷,首先將允許蛋白質到達內質網的信號肽去除,使成熟的蛋白質能夠完成其特定的功能。由慕尼黑工業大學(TUM)細胞蛋白生物化學教授Matthias Feige和科隆大學生物化學教授Marius Lemberg領導的研究小組現在發現,信號肽酶復合物在細胞生物學的另一個關鍵過程中具有迄今為止未知的功能:膜蛋白的質量控制。

圖1 研究人員發現了一種眾所周知的酶的新功能:信號肽酶復合體負責膜蛋白的質量控制(圖源:[1])
每個細胞都被一層脂質雙分子層包圍,它保護細胞內部,但也要求通過這層絕緣層調節分子和信號的運輸,以實現大量的細胞功能。膜蛋白被整合到這個脂質雙分子層中并執行這些功能。它們是細胞生存所必需的,也是最重要的藥物靶點。為了正常工作,膜蛋白需要在原子水平上采用明確的三維結構。這一過程的失敗可能導致錯誤的蛋白質,進而導致許多疾病,包括癌癥以及代謝和神經退行性疾病。
為了更好地了解我們的細胞是如何避免這些有缺陷的蛋白質破壞它們并導致疾病,該團隊探索了幾種與我們神經系統疾病相關的膜蛋白。在他們的研究過程中,他們觀察到一種蛋白酶——一種分解其他蛋白質的酶——啟動了缺陷突變蛋白質的降解。這種降解對維持細胞功能至關重要。然而,他們無法確定所涉及的蛋白酶。Feige說:“所有已知的候選藥物和常用的抑制劑都不能幫助我們探索潛在的分子機制。”
在研究人員識別出信號肽酶復合體的潛在切割位點后,取得了突破。Lemberg補充說:“根據已有的教科書,信號肽酶復合體在分泌蛋白成熟過程中分裂信號肽,到目前為止,大多數人認為這是它的唯一功能。”然而,研究人員發現信號肽酶復合體就是他們正在尋找的蛋白酶,揭示了它在膜蛋白質量控制中起著至關重要的作用。
隨后,跨學科的研究團隊發現了幾個額外的被分裂的蛋白質,以及這個意想不到的功能可能是如何被信號肽酶亞基SPCS1調節的。Feige解釋說:“由于這個因子對蛋白質成熟過程中最初描述的作用并不是必需的,我們意識到我們正在處理的是一種以前未被認識到的功能。”
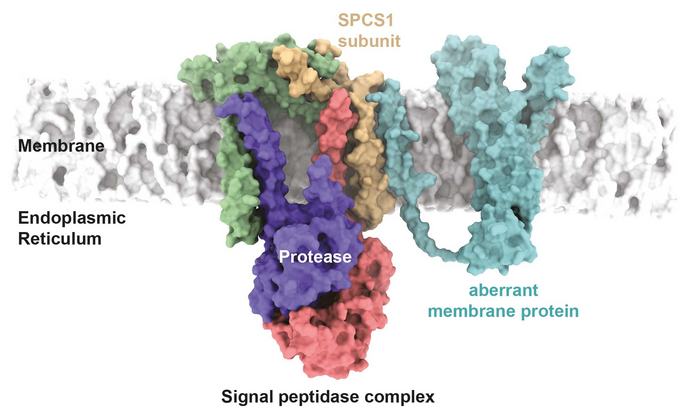
圖2 信號肽酶復合物識別突變膜蛋白的假設模型。疾病相關的Cx32突變體在模型中與信號肽酶復合物的SPCS1亞基相互作用(圖源:[1])
Lemberg補充說:“有趣的是,SPCS1是阿爾茨海默癥患者大腦所有區域中僅有的三個下調基因之一,這表明我們的發現可能對我們理解人類生物學和年齡相關疾病有重要意義。”在阿爾茨海默病中,錯誤的蛋白質堆積起來,這被認為會損害神經元功能。Feige總結道:“我們的發現將幫助我們更好地理解細胞如何控制蛋白質的分子形狀,并為未來的許多研究奠定基礎。”
參考資料:
[1] The human signal peptidase complex acts as a quality control enzyme for membrane proteins
摘要:研究人員發現了一種眾所周知的酶的新功能:信號肽酶復合體負責膜蛋白的質量控制。細胞生物學中一種關鍵酶的新功能的發現已經發表在《Science》雜志上,這可能會為阿爾茨海默癥和其他蛋白質錯誤折疊疾病帶來新的治療方法。
來自科隆、海德堡和慕尼黑的一個跨學科科學家團隊發現了一種著名酶的新功能:內質網中的信號肽酶復合體分裂有缺陷的膜蛋白,啟動它們的降解。在我們的細胞中,內質網負責產生和控制從細胞中分泌的蛋白質。信號肽酶復合體將這些多肽鏈切斷,首先將允許蛋白質到達內質網的信號肽去除,使成熟的蛋白質能夠完成其特定的功能。由慕尼黑工業大學(TUM)細胞蛋白生物化學教授Matthias Feige和科隆大學生物化學教授Marius Lemberg領導的研究小組現在發現,信號肽酶復合物在細胞生物學的另一個關鍵過程中具有迄今為止未知的功能:膜蛋白的質量控制。

圖1 研究人員發現了一種眾所周知的酶的新功能:信號肽酶復合體負責膜蛋白的質量控制(圖源:[1])
每個細胞都被一層脂質雙分子層包圍,它保護細胞內部,但也要求通過這層絕緣層調節分子和信號的運輸,以實現大量的細胞功能。膜蛋白被整合到這個脂質雙分子層中并執行這些功能。它們是細胞生存所必需的,也是最重要的藥物靶點。為了正常工作,膜蛋白需要在原子水平上采用明確的三維結構。這一過程的失敗可能導致錯誤的蛋白質,進而導致許多疾病,包括癌癥以及代謝和神經退行性疾病。
為了更好地了解我們的細胞是如何避免這些有缺陷的蛋白質破壞它們并導致疾病,該團隊探索了幾種與我們神經系統疾病相關的膜蛋白。在他們的研究過程中,他們觀察到一種蛋白酶——一種分解其他蛋白質的酶——啟動了缺陷突變蛋白質的降解。這種降解對維持細胞功能至關重要。然而,他們無法確定所涉及的蛋白酶。Feige說:“所有已知的候選藥物和常用的抑制劑都不能幫助我們探索潛在的分子機制。”
在研究人員識別出信號肽酶復合體的潛在切割位點后,取得了突破。Lemberg補充說:“根據已有的教科書,信號肽酶復合體在分泌蛋白成熟過程中分裂信號肽,到目前為止,大多數人認為這是它的唯一功能。”然而,研究人員發現信號肽酶復合體就是他們正在尋找的蛋白酶,揭示了它在膜蛋白質量控制中起著至關重要的作用。
隨后,跨學科的研究團隊發現了幾個額外的被分裂的蛋白質,以及這個意想不到的功能可能是如何被信號肽酶亞基SPCS1調節的。Feige解釋說:“由于這個因子對蛋白質成熟過程中最初描述的作用并不是必需的,我們意識到我們正在處理的是一種以前未被認識到的功能。”

圖2 信號肽酶復合物識別突變膜蛋白的假設模型。疾病相關的Cx32突變體在模型中與信號肽酶復合物的SPCS1亞基相互作用(圖源:[1])
Lemberg補充說:“有趣的是,SPCS1是阿爾茨海默癥患者大腦所有區域中僅有的三個下調基因之一,這表明我們的發現可能對我們理解人類生物學和年齡相關疾病有重要意義。”在阿爾茨海默病中,錯誤的蛋白質堆積起來,這被認為會損害神經元功能。Feige總結道:“我們的發現將幫助我們更好地理解細胞如何控制蛋白質的分子形狀,并為未來的許多研究奠定基礎。”
參考資料:
[1] The human signal peptidase complex acts as a quality control enzyme for membrane proteins



