摘要:西奈山伊坎醫(yī)學(xué)院的研究人員從蝙蝠身上培育出了第一個(gè)誘導(dǎo)多能干細(xì)胞(iPSCs),對(duì)蝙蝠和病毒之間的密切關(guān)系獲得了有價(jià)值的見(jiàn)解。
西奈山伊坎醫(yī)學(xué)院的研究人員從蝙蝠身上培育出了第一個(gè)誘導(dǎo)多能干細(xì)胞(iPSCs),對(duì)蝙蝠和病毒之間的密切關(guān)系獲得了有價(jià)值的見(jiàn)解。這項(xiàng)研究為研究導(dǎo)致COVID-19的SARS-CoV-2等病毒如何通過(guò)對(duì)新宿主的分子適應(yīng)來(lái)生存、傳播和逃避免疫系統(tǒng)打開了大門。
該小組的研究結(jié)果發(fā)表在2月21日的《Cell》雜志上,可能還揭示了蝙蝠的獨(dú)特特性,這些特性是它們對(duì)抗衰老和癌癥的顯著防御的基礎(chǔ)。

圖1 研究人員從蝙蝠身上培育出了第一個(gè)誘導(dǎo)多能干細(xì)胞(iPSCs)
誘導(dǎo)多能干細(xì)胞是通過(guò)基因和化學(xué)方法將皮膚或血液細(xì)胞重新編程為新生干細(xì)胞而產(chǎn)生的,這些干細(xì)胞有可能成為身體中的任何細(xì)胞。到目前為止,還沒(méi)有可靠的細(xì)胞模型來(lái)研究蝙蝠生物學(xué)或它們對(duì)病毒感染的反應(yīng),從而阻礙了對(duì)它們基因組適應(yīng)性的更深入了解。西奈山醫(yī)學(xué)院的研究小組正在幫助從野生大馬鐵菊頭蝠(Rhinolophus ferrumequinum)身上創(chuàng)造誘導(dǎo)多能干細(xì)胞,以填補(bǔ)這一空白。Thomas Zwaka博士在西奈山的實(shí)驗(yàn)室專注于干細(xì)胞生物學(xué)的基本問(wèn)題。
馬鐵菊頭蝠是冠狀病毒(包括與SARS-CoV-2密切相關(guān)的病毒)最常見(jiàn)的無(wú)癥狀攜帶者。研究人員認(rèn)為,他們創(chuàng)造的蝙蝠干細(xì)胞模型將為科學(xué)界提供一個(gè)特殊的工具。該研究的第一作者,伊坎西奈山的細(xì)胞、發(fā)育和再生生物學(xué)副教授Marion Dejosez博士指出,“多能干細(xì)胞具有獨(dú)特的能力,可以在培養(yǎng)中無(wú)限分裂,并轉(zhuǎn)化為免疫細(xì)胞和組織(如肺或腸道上皮),使它們適合基因編輯和分子研究。”
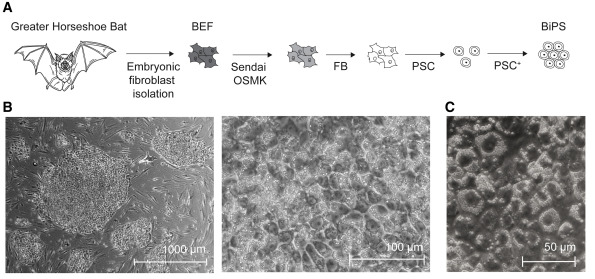
圖2 馬鐵菊頭蝠多能干細(xì)胞的制備
反過(guò)來(lái),這項(xiàng)研究可以幫助回答一些重要的問(wèn)題,比如蝙蝠是如何忍受病毒感染的,以及它們是否在基因上模擬了病毒逃避免疫系統(tǒng)的策略,從而為病毒的產(chǎn)生提供了肥沃的土壤。這項(xiàng)研究幫助回答的另一個(gè)問(wèn)題是,病毒是否作為宿主生物學(xué)的完全稱職的代理和編輯,從而使它們成為豐富的進(jìn)化指令來(lái)源。
資深作者、伊坎西奈山細(xì)胞、發(fā)育和再生生物學(xué)教授Thomas Zwaka說(shuō):“我們的研究表明,蝙蝠已經(jīng)進(jìn)化出了耐受大量病毒序列的機(jī)制,它們與病毒的關(guān)系可能比以前認(rèn)為的更緊密,鑒于許多蝙蝠物種已被證明能夠耐受并存活在對(duì)人類具有高死亡率的病毒,包括SARS-CoV、SARS-CoV-2、MERS-CoV和馬爾堡病毒,這具有新的相關(guān)性。原因可能是蝙蝠的先天免疫反應(yīng)受到了調(diào)節(jié),這使得它們對(duì)病毒宿主無(wú)癥狀和耐受。”
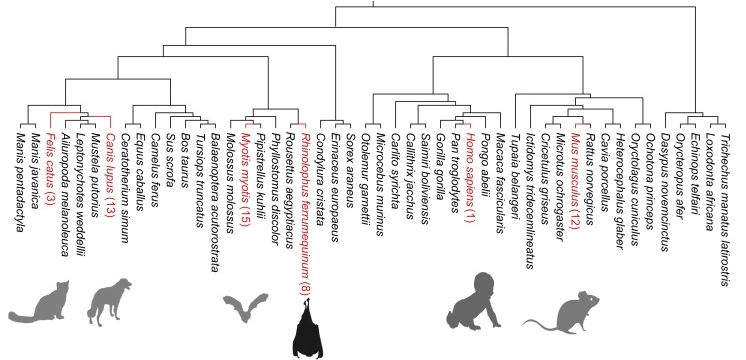
圖3 蝙蝠多能干細(xì)胞的獨(dú)特特性
“將蝙蝠的iPSCs與其他哺乳動(dòng)物進(jìn)行比較,使我們能夠發(fā)現(xiàn)一種以前從未觀察到的獨(dú)特的干細(xì)胞生物學(xué),”合著者Adolfo García-Sastre博士說(shuō)。“最不尋常的發(fā)現(xiàn)是在蝙蝠干細(xì)胞中存在充滿病毒的大囊泡,代表了包括冠狀病毒在內(nèi)的主要病毒家族,而不影響細(xì)胞增殖和生長(zhǎng)的能力。這可能為病毒耐受性以及蝙蝠和病毒之間的共生關(guān)系提供了一種新的范式。”
Zwaka博士解釋說(shuō):“未來(lái)對(duì)蝙蝠干細(xì)胞的研究將直接影響我們對(duì)蝙蝠生物學(xué)的各個(gè)方面的理解,包括蝙蝠驚人的飛行適應(yīng)性和通過(guò)回聲定位遠(yuǎn)處或看不見(jiàn)的物體的能力,聲音反映物體的位置,以及它們的極端壽命和不同尋常的免疫力。”
García-Sastre博士說(shuō):“我們的研究為進(jìn)一步了解蝙蝠在哺乳動(dòng)物中作為病毒宿主所起的獨(dú)特作用建立了一個(gè)平臺(tái)。這些知識(shí)可以為該領(lǐng)域提供對(duì)疾病和治療方法的廣泛新見(jiàn)解,同時(shí)為我們應(yīng)對(duì)未來(lái)的大流行做好準(zhǔn)備。”
參考資料:
[1]Bat pluripotent stem cells reveal unusual entanglement between host and viruses
摘要:西奈山伊坎醫(yī)學(xué)院的研究人員從蝙蝠身上培育出了第一個(gè)誘導(dǎo)多能干細(xì)胞(iPSCs),對(duì)蝙蝠和病毒之間的密切關(guān)系獲得了有價(jià)值的見(jiàn)解。
西奈山伊坎醫(yī)學(xué)院的研究人員從蝙蝠身上培育出了第一個(gè)誘導(dǎo)多能干細(xì)胞(iPSCs),對(duì)蝙蝠和病毒之間的密切關(guān)系獲得了有價(jià)值的見(jiàn)解。這項(xiàng)研究為研究導(dǎo)致COVID-19的SARS-CoV-2等病毒如何通過(guò)對(duì)新宿主的分子適應(yīng)來(lái)生存、傳播和逃避免疫系統(tǒng)打開了大門。
該小組的研究結(jié)果發(fā)表在2月21日的《Cell》雜志上,可能還揭示了蝙蝠的獨(dú)特特性,這些特性是它們對(duì)抗衰老和癌癥的顯著防御的基礎(chǔ)。

圖1 研究人員從蝙蝠身上培育出了第一個(gè)誘導(dǎo)多能干細(xì)胞(iPSCs)
誘導(dǎo)多能干細(xì)胞是通過(guò)基因和化學(xué)方法將皮膚或血液細(xì)胞重新編程為新生干細(xì)胞而產(chǎn)生的,這些干細(xì)胞有可能成為身體中的任何細(xì)胞。到目前為止,還沒(méi)有可靠的細(xì)胞模型來(lái)研究蝙蝠生物學(xué)或它們對(duì)病毒感染的反應(yīng),從而阻礙了對(duì)它們基因組適應(yīng)性的更深入了解。西奈山醫(yī)學(xué)院的研究小組正在幫助從野生大馬鐵菊頭蝠(Rhinolophus ferrumequinum)身上創(chuàng)造誘導(dǎo)多能干細(xì)胞,以填補(bǔ)這一空白。Thomas Zwaka博士在西奈山的實(shí)驗(yàn)室專注于干細(xì)胞生物學(xué)的基本問(wèn)題。
馬鐵菊頭蝠是冠狀病毒(包括與SARS-CoV-2密切相關(guān)的病毒)最常見(jiàn)的無(wú)癥狀攜帶者。研究人員認(rèn)為,他們創(chuàng)造的蝙蝠干細(xì)胞模型將為科學(xué)界提供一個(gè)特殊的工具。該研究的第一作者,伊坎西奈山的細(xì)胞、發(fā)育和再生生物學(xué)副教授Marion Dejosez博士指出,“多能干細(xì)胞具有獨(dú)特的能力,可以在培養(yǎng)中無(wú)限分裂,并轉(zhuǎn)化為免疫細(xì)胞和組織(如肺或腸道上皮),使它們適合基因編輯和分子研究。”

圖2 馬鐵菊頭蝠多能干細(xì)胞的制備
反過(guò)來(lái),這項(xiàng)研究可以幫助回答一些重要的問(wèn)題,比如蝙蝠是如何忍受病毒感染的,以及它們是否在基因上模擬了病毒逃避免疫系統(tǒng)的策略,從而為病毒的產(chǎn)生提供了肥沃的土壤。這項(xiàng)研究幫助回答的另一個(gè)問(wèn)題是,病毒是否作為宿主生物學(xué)的完全稱職的代理和編輯,從而使它們成為豐富的進(jìn)化指令來(lái)源。
資深作者、伊坎西奈山細(xì)胞、發(fā)育和再生生物學(xué)教授Thomas Zwaka說(shuō):“我們的研究表明,蝙蝠已經(jīng)進(jìn)化出了耐受大量病毒序列的機(jī)制,它們與病毒的關(guān)系可能比以前認(rèn)為的更緊密,鑒于許多蝙蝠物種已被證明能夠耐受并存活在對(duì)人類具有高死亡率的病毒,包括SARS-CoV、SARS-CoV-2、MERS-CoV和馬爾堡病毒,這具有新的相關(guān)性。原因可能是蝙蝠的先天免疫反應(yīng)受到了調(diào)節(jié),這使得它們對(duì)病毒宿主無(wú)癥狀和耐受。”

圖3 蝙蝠多能干細(xì)胞的獨(dú)特特性
“將蝙蝠的iPSCs與其他哺乳動(dòng)物進(jìn)行比較,使我們能夠發(fā)現(xiàn)一種以前從未觀察到的獨(dú)特的干細(xì)胞生物學(xué),”合著者Adolfo García-Sastre博士說(shuō)。“最不尋常的發(fā)現(xiàn)是在蝙蝠干細(xì)胞中存在充滿病毒的大囊泡,代表了包括冠狀病毒在內(nèi)的主要病毒家族,而不影響細(xì)胞增殖和生長(zhǎng)的能力。這可能為病毒耐受性以及蝙蝠和病毒之間的共生關(guān)系提供了一種新的范式。”
Zwaka博士解釋說(shuō):“未來(lái)對(duì)蝙蝠干細(xì)胞的研究將直接影響我們對(duì)蝙蝠生物學(xué)的各個(gè)方面的理解,包括蝙蝠驚人的飛行適應(yīng)性和通過(guò)回聲定位遠(yuǎn)處或看不見(jiàn)的物體的能力,聲音反映物體的位置,以及它們的極端壽命和不同尋常的免疫力。”
García-Sastre博士說(shuō):“我們的研究為進(jìn)一步了解蝙蝠在哺乳動(dòng)物中作為病毒宿主所起的獨(dú)特作用建立了一個(gè)平臺(tái)。這些知識(shí)可以為該領(lǐng)域提供對(duì)疾病和治療方法的廣泛新見(jiàn)解,同時(shí)為我們應(yīng)對(duì)未來(lái)的大流行做好準(zhǔn)備。”
參考資料:
[1]Bat pluripotent stem cells reveal unusual entanglement between host and viruses



