摘要:“用進(jìn)廢退”這句俗語廣泛適用于從人體肌肉到思想的一切事物,隨著年齡的增長(zhǎng),這種趨勢(shì)會(huì)愈加明顯。
“用進(jìn)廢退”這句俗語廣泛適用于從人體肌肉到思想的一切事物,隨著年齡的增長(zhǎng),這種趨勢(shì)會(huì)愈加明顯。但當(dāng)涉及大腦時(shí),這種使用或許并不是一件好事。盡管腦細(xì)胞的使用確實(shí)可能有助于保持整個(gè)生命過程中的記憶和其他認(rèn)知功能,但科學(xué)家卻發(fā)現(xiàn)相關(guān)的大腦活動(dòng)會(huì)引發(fā)大量DNA的斷裂,進(jìn)而損傷神經(jīng)元。
基于此,我們想要知道的是,神經(jīng)元如何在大腦中執(zhí)行其重要工作的一生中保持健康和功能正常的呢?
近日,來自哈佛醫(yī)學(xué)院的研究人員在Nature上發(fā)表了一篇題為“A NPAS4-NuA4 complex couples synaptic activity to DNA repair”的研究論文。該項(xiàng)研究發(fā)現(xiàn)了神經(jīng)元中存在著一種獨(dú)特的DNA修復(fù)機(jī)制,解釋了為什么神經(jīng)元在高強(qiáng)度重復(fù)工作的情況下仍然能夠持續(xù)發(fā)揮作用。

圖1 研究發(fā)現(xiàn)了神經(jīng)元中存在著一種獨(dú)特的DNA修復(fù)機(jī)制(圖源:[1])
在人體內(nèi)所有的細(xì)胞類型中,神經(jīng)元是與眾不同的,原因在于其不會(huì)再生或復(fù)制。日復(fù)一日,年復(fù)一年,它們不知疲倦地根據(jù)環(huán)境線索改造自己,確保大腦能夠在一生中都能保持正常運(yùn)行。這種重塑過程部分是通過激活大腦中基因轉(zhuǎn)錄的新程序來完成的,神經(jīng)元使用這些程序?qū)NA轉(zhuǎn)化為組裝蛋白質(zhì)的指令。但神經(jīng)元中的這種活躍轉(zhuǎn)錄帶來了高昂的代價(jià),即這一過程加速了DNA的斷裂,破壞了制造對(duì)細(xì)胞功能至關(guān)重要的蛋白質(zhì)所需的遺傳指令。
研究人員之一Daniel Gilliam表示,生物學(xué)層面上存在的這種矛盾,對(duì)神經(jīng)元的功能及存活至關(guān)重要,但對(duì)細(xì)胞DNA也確實(shí)是存在傷害。他們開始對(duì)大腦如何平衡神經(jīng)元的成本和收益感興趣,對(duì)此,Pollina表示:“我們想知道神經(jīng)元是否有特定的機(jī)制來減輕這種傷害,以便讓我們保持思考、學(xué)習(xí)和記憶。”
在這項(xiàng)研究中,研究人員的注意力集中在轉(zhuǎn)錄因子NPAS4上,其功能由Michael Greenberg的實(shí)驗(yàn)室于2008年發(fā)現(xiàn)。NPAS4是一種已知對(duì)神經(jīng)元具有高度特異性的蛋白質(zhì),它調(diào)節(jié)活動(dòng)依賴性基因的表達(dá),以控制興奮性神經(jīng)元對(duì)外界刺激的反應(yīng)抑制。
研究人員在小鼠身上進(jìn)行了一系列生化和基因組實(shí)驗(yàn)。首先,他們確定NPAS4作為由21種不同蛋白質(zhì)組成的復(fù)合物的一部分存在,稱為NPAS4-NuA4。研究人員發(fā)現(xiàn),NPAS4-NuA4復(fù)合物在激活的神經(jīng)元中組裝以協(xié)調(diào)誘導(dǎo)基因轉(zhuǎn)錄并動(dòng)態(tài)重組大腦中受刺激的神經(jīng)元回路。
接下來,通過γH2AX ChIP-seq、sBLISS-seq 和 END-seq 對(duì)DNA損傷的獨(dú)立測(cè)量表明NPAS4優(yōu)先結(jié)合神經(jīng)元中經(jīng)歷活性誘導(dǎo)DNA斷裂的位點(diǎn),同時(shí)還發(fā)現(xiàn),NPAS4-NuA4結(jié)合位點(diǎn)是激活神經(jīng)元中DNA損傷和修復(fù)的熱點(diǎn)。
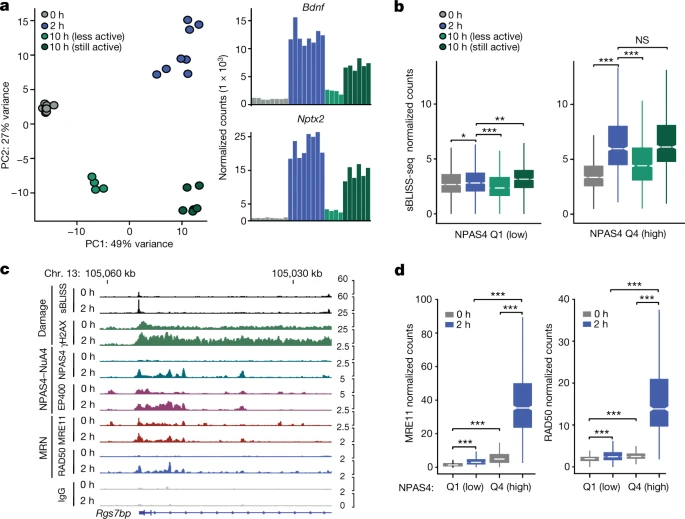
圖2 NPAS4-NuA4結(jié)合位點(diǎn)隨著可誘導(dǎo)轉(zhuǎn)錄的消退進(jìn)行DNA修復(fù)(圖源:[1])
試驗(yàn)數(shù)據(jù)表明,NPAS4-NuA4功能的破壞會(huì)導(dǎo)致活性依賴性基因表達(dá)失調(diào)、活性調(diào)節(jié)啟動(dòng)子和增強(qiáng)子處的DNA斷裂增加、保護(hù)性修復(fù)機(jī)制的定位受損以及錐體神經(jīng)元體細(xì)胞抑制缺陷。據(jù)此,研究人員推斷,隨著動(dòng)物年齡的增長(zhǎng),NPAS4-NuA4復(fù)合物的破壞最終會(huì)產(chǎn)生廣泛的長(zhǎng)期后果。這些變化可能包括對(duì)基因組完整性、興奮性/抑制性平衡和有機(jī)體壽命的有害影響。
值得注意的是,研究人員觀察到這種神經(jīng)元因子的缺失大大縮短了雄性和雌性小鼠的壽命,導(dǎo)致其中位壽命分別為12個(gè)月和11個(gè)月。種系Npas4基因敲除小鼠的壽命縮短特別是由于大腦中NPAS4的丟失,這一點(diǎn)得到了snRNA-seq數(shù)據(jù)的支持,該數(shù)據(jù)表明NPAS4對(duì)神經(jīng)元具有高度特異性。
通過該項(xiàng)研究,研究人員確定了NuA4復(fù)合物的一種特殊神經(jīng)元形式,它在激活的神經(jīng)元中圍繞NPAS4組裝,以調(diào)節(jié)細(xì)胞類型特異性誘導(dǎo)轉(zhuǎn)錄并抑制DNA損傷。未來的研究將探索神經(jīng)元用于修復(fù)活動(dòng)引起的損傷的精確機(jī)制,包括那些由NPAS-4-NuA4介導(dǎo)的機(jī)制,這將是重要的研究領(lǐng)域。
研究人員之一的Greenberg渴望更深入地研究該機(jī)制的細(xì)節(jié),以了解復(fù)合物中的每種蛋白質(zhì)在做什么,涉及哪些其他分子,以及修復(fù)過程究竟是如何進(jìn)行的。他表示下一步是在人類神經(jīng)元中再次進(jìn)行試驗(yàn)。
如果以上研究結(jié)果在人類身上再次得到證實(shí),這些發(fā)現(xiàn)會(huì)讓科學(xué)家們更加深入了解神經(jīng)元如何以及為什么會(huì)隨著衰老以及罹患神經(jīng)退行性疾病而崩潰,還可以幫助科學(xué)家們制定策略以保護(hù)神經(jīng)元基因組中易受損的其他區(qū)域,或治療神經(jīng)元DNA修復(fù)出現(xiàn)問題的疾病。
參考資料:
[1] Pollina EA, Gilliam DT, Landau AT, et al. A NPAS4-NuA4 complex couples synaptic activity to DNA repair. Nature. 2023 Feb 15. doi: 10.1038/s41586-023-05711-7. Epub ahead of print. PMID: 36792830.
摘要:“用進(jìn)廢退”這句俗語廣泛適用于從人體肌肉到思想的一切事物,隨著年齡的增長(zhǎng),這種趨勢(shì)會(huì)愈加明顯。
“用進(jìn)廢退”這句俗語廣泛適用于從人體肌肉到思想的一切事物,隨著年齡的增長(zhǎng),這種趨勢(shì)會(huì)愈加明顯。但當(dāng)涉及大腦時(shí),這種使用或許并不是一件好事。盡管腦細(xì)胞的使用確實(shí)可能有助于保持整個(gè)生命過程中的記憶和其他認(rèn)知功能,但科學(xué)家卻發(fā)現(xiàn)相關(guān)的大腦活動(dòng)會(huì)引發(fā)大量DNA的斷裂,進(jìn)而損傷神經(jīng)元。
基于此,我們想要知道的是,神經(jīng)元如何在大腦中執(zhí)行其重要工作的一生中保持健康和功能正常的呢?
近日,來自哈佛醫(yī)學(xué)院的研究人員在Nature上發(fā)表了一篇題為“A NPAS4-NuA4 complex couples synaptic activity to DNA repair”的研究論文。該項(xiàng)研究發(fā)現(xiàn)了神經(jīng)元中存在著一種獨(dú)特的DNA修復(fù)機(jī)制,解釋了為什么神經(jīng)元在高強(qiáng)度重復(fù)工作的情況下仍然能夠持續(xù)發(fā)揮作用。

圖1 研究發(fā)現(xiàn)了神經(jīng)元中存在著一種獨(dú)特的DNA修復(fù)機(jī)制(圖源:[1])
在人體內(nèi)所有的細(xì)胞類型中,神經(jīng)元是與眾不同的,原因在于其不會(huì)再生或復(fù)制。日復(fù)一日,年復(fù)一年,它們不知疲倦地根據(jù)環(huán)境線索改造自己,確保大腦能夠在一生中都能保持正常運(yùn)行。這種重塑過程部分是通過激活大腦中基因轉(zhuǎn)錄的新程序來完成的,神經(jīng)元使用這些程序?qū)NA轉(zhuǎn)化為組裝蛋白質(zhì)的指令。但神經(jīng)元中的這種活躍轉(zhuǎn)錄帶來了高昂的代價(jià),即這一過程加速了DNA的斷裂,破壞了制造對(duì)細(xì)胞功能至關(guān)重要的蛋白質(zhì)所需的遺傳指令。
研究人員之一Daniel Gilliam表示,生物學(xué)層面上存在的這種矛盾,對(duì)神經(jīng)元的功能及存活至關(guān)重要,但對(duì)細(xì)胞DNA也確實(shí)是存在傷害。他們開始對(duì)大腦如何平衡神經(jīng)元的成本和收益感興趣,對(duì)此,Pollina表示:“我們想知道神經(jīng)元是否有特定的機(jī)制來減輕這種傷害,以便讓我們保持思考、學(xué)習(xí)和記憶。”
在這項(xiàng)研究中,研究人員的注意力集中在轉(zhuǎn)錄因子NPAS4上,其功能由Michael Greenberg的實(shí)驗(yàn)室于2008年發(fā)現(xiàn)。NPAS4是一種已知對(duì)神經(jīng)元具有高度特異性的蛋白質(zhì),它調(diào)節(jié)活動(dòng)依賴性基因的表達(dá),以控制興奮性神經(jīng)元對(duì)外界刺激的反應(yīng)抑制。
研究人員在小鼠身上進(jìn)行了一系列生化和基因組實(shí)驗(yàn)。首先,他們確定NPAS4作為由21種不同蛋白質(zhì)組成的復(fù)合物的一部分存在,稱為NPAS4-NuA4。研究人員發(fā)現(xiàn),NPAS4-NuA4復(fù)合物在激活的神經(jīng)元中組裝以協(xié)調(diào)誘導(dǎo)基因轉(zhuǎn)錄并動(dòng)態(tài)重組大腦中受刺激的神經(jīng)元回路。
接下來,通過γH2AX ChIP-seq、sBLISS-seq 和 END-seq 對(duì)DNA損傷的獨(dú)立測(cè)量表明NPAS4優(yōu)先結(jié)合神經(jīng)元中經(jīng)歷活性誘導(dǎo)DNA斷裂的位點(diǎn),同時(shí)還發(fā)現(xiàn),NPAS4-NuA4結(jié)合位點(diǎn)是激活神經(jīng)元中DNA損傷和修復(fù)的熱點(diǎn)。

圖2 NPAS4-NuA4結(jié)合位點(diǎn)隨著可誘導(dǎo)轉(zhuǎn)錄的消退進(jìn)行DNA修復(fù)(圖源:[1])
試驗(yàn)數(shù)據(jù)表明,NPAS4-NuA4功能的破壞會(huì)導(dǎo)致活性依賴性基因表達(dá)失調(diào)、活性調(diào)節(jié)啟動(dòng)子和增強(qiáng)子處的DNA斷裂增加、保護(hù)性修復(fù)機(jī)制的定位受損以及錐體神經(jīng)元體細(xì)胞抑制缺陷。據(jù)此,研究人員推斷,隨著動(dòng)物年齡的增長(zhǎng),NPAS4-NuA4復(fù)合物的破壞最終會(huì)產(chǎn)生廣泛的長(zhǎng)期后果。這些變化可能包括對(duì)基因組完整性、興奮性/抑制性平衡和有機(jī)體壽命的有害影響。
值得注意的是,研究人員觀察到這種神經(jīng)元因子的缺失大大縮短了雄性和雌性小鼠的壽命,導(dǎo)致其中位壽命分別為12個(gè)月和11個(gè)月。種系Npas4基因敲除小鼠的壽命縮短特別是由于大腦中NPAS4的丟失,這一點(diǎn)得到了snRNA-seq數(shù)據(jù)的支持,該數(shù)據(jù)表明NPAS4對(duì)神經(jīng)元具有高度特異性。
通過該項(xiàng)研究,研究人員確定了NuA4復(fù)合物的一種特殊神經(jīng)元形式,它在激活的神經(jīng)元中圍繞NPAS4組裝,以調(diào)節(jié)細(xì)胞類型特異性誘導(dǎo)轉(zhuǎn)錄并抑制DNA損傷。未來的研究將探索神經(jīng)元用于修復(fù)活動(dòng)引起的損傷的精確機(jī)制,包括那些由NPAS-4-NuA4介導(dǎo)的機(jī)制,這將是重要的研究領(lǐng)域。
研究人員之一的Greenberg渴望更深入地研究該機(jī)制的細(xì)節(jié),以了解復(fù)合物中的每種蛋白質(zhì)在做什么,涉及哪些其他分子,以及修復(fù)過程究竟是如何進(jìn)行的。他表示下一步是在人類神經(jīng)元中再次進(jìn)行試驗(yàn)。
如果以上研究結(jié)果在人類身上再次得到證實(shí),這些發(fā)現(xiàn)會(huì)讓科學(xué)家們更加深入了解神經(jīng)元如何以及為什么會(huì)隨著衰老以及罹患神經(jīng)退行性疾病而崩潰,還可以幫助科學(xué)家們制定策略以保護(hù)神經(jīng)元基因組中易受損的其他區(qū)域,或治療神經(jīng)元DNA修復(fù)出現(xiàn)問題的疾病。
參考資料:
[1] Pollina EA, Gilliam DT, Landau AT, et al. A NPAS4-NuA4 complex couples synaptic activity to DNA repair. Nature. 2023 Feb 15. doi: 10.1038/s41586-023-05711-7. Epub ahead of print. PMID: 36792830.



