摘要:賓夕法尼亞大學佩雷爾曼醫學院的研究人員進行了一項臨床前研究,其重點在于一種新方法,即“組合拳”幫助T細胞攻擊實體腫瘤。
賓夕法尼亞大學佩雷爾曼醫學院的研究人員進行了一項臨床前研究,其重點在于一種新方法,即“組合拳”幫助T細胞攻擊實體腫瘤。發表在《美國國家科學院院刊》(PNAS)上的研究結果表明,靶向控制炎癥相關基因功能的兩種調節因子,可使模型中的T細胞至少增加10倍,從而增強抗腫瘤免疫活性和持久性。

圖1 靶向控制炎癥相關基因功能的兩種調節因子可使模型中的T細胞至少增加10倍
CAR-T細胞療法由Carl H. June醫學博士首創,他是賓夕法尼亞大學免疫療法教授,也是Abramson癌癥中心細胞免疫療法(CCI)主任,他的工作導致了2017年首次批準用于B細胞急性淋巴細胞白血病的CAR - T細胞療法。從那時起,個性化細胞療法徹底改變了血癌的治療方法,但對肺癌和乳腺癌等實體腫瘤仍然無效。
對于這項新研究,June表示:“我們希望為實體瘤患者開啟CAR-T細胞療法,其中包括最常見的癌癥類型。我們的研究表明,免疫炎癥調節劑靶向(immune inflammatory regulator targeting)值得進一步研究,增強T細胞的效力。”
CAR-T細胞治療實體腫瘤的挑戰之一是一種被稱為T細胞衰竭的現象,即來自實體腫瘤細胞的持續抗原暴露使T細胞疲憊不堪,不能產生抗腫瘤反應。將病人體內已經耗盡的T細胞用于CAR - T細胞治療會導致效果較差,因為T細胞不能充分繁殖,也不能記住它們的任務。
先前的觀察性研究暗示,炎癥調節因子Regnase-1是間接克服T細胞衰竭影響的潛在靶點,因為當T細胞被破壞時,Regnase-1會引起過度炎癥,使它們復活以產生抗腫瘤反應。該論文一作David Mai博士,提出同時針對相關但獨立的Roquin-1調節器可以進一步促進反應。
Mai說:“這兩個調節基因中的每一個都涉及限制T細胞炎癥反應,但我們發現,將它們放在一起比單獨破壞它們產生更大的抗癌效果。在之前研究的基礎上,我們開始越來越接近在實體瘤環境下有前景的策略。”
該團隊使用CRISPR-Cas9基因編輯技術分別敲除Regnase-1和Roquin-1,并同時敲除健康供體T細胞中的兩種不同的免疫受體,目前正在I期臨床試驗中進行研究:間皮素靶向M5 CAR (mesoCAR)和NY-ESO-1靶向8F TCR (NYESO TCR)。這兩種工程T細胞產品都不是針對CD19的,因為這種抗原不存在于實體腫瘤中,而CD19是大多數被批準的CAR-T細胞療法靶向的抗原。
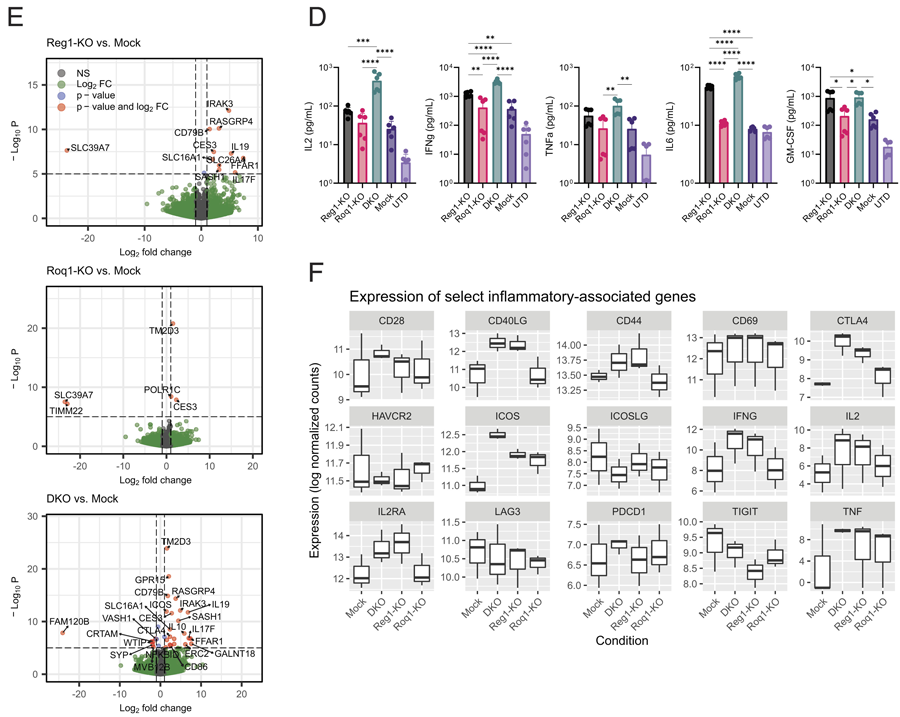
圖2 Regnase-1和Roquin-1雙敲除
在CRISPR編輯后,T細胞被擴增并注入實體瘤小鼠模型中,研究人員觀察到,與單獨禁用Regnase-1相比,雙重敲除導致至少10倍的工程T細胞,以及增加的抗腫瘤免疫活性和工程T細胞的壽命。在一些小鼠中,它還導致淋巴細胞產生過剩,導致毒性。
Sheppard說:“CRISPR是一種有用的工具,可以完全消除Regnase和Roquin等靶基因的表達,從而產生明確的表型,然而,還有其他策略可以考慮將這項工作轉化為臨床環境,例如條件基因調控的形式。”“我們當然對結合敲除這兩種非冗余蛋白質所釋放的抗腫瘤效力印象深刻。在實體腫瘤研究中,我們經常看到CAR - T細胞的有限擴張,但如果我們能夠使每個T細胞更有效,并大量復制它們,我們預計T細胞療法將有更好的機會攻擊實體腫瘤。”
其他作者還包括Omar Johnson, Jordan ref, Ting-Jia Fan和John Scholler。這項研究得到了美國國立衛生研究院(1P01CA214278, R01CA226983)、帕克癌癥免疫治療研究所、愛默生集體、方丹獎學金、諾曼和塞爾瑪·克倫研究獎學金以及羅伯特·伍德·約翰遜基金會衛生政策研究學者的支持。
參考資料:
[1] Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells
摘要:賓夕法尼亞大學佩雷爾曼醫學院的研究人員進行了一項臨床前研究,其重點在于一種新方法,即“組合拳”幫助T細胞攻擊實體腫瘤。
賓夕法尼亞大學佩雷爾曼醫學院的研究人員進行了一項臨床前研究,其重點在于一種新方法,即“組合拳”幫助T細胞攻擊實體腫瘤。發表在《美國國家科學院院刊》(PNAS)上的研究結果表明,靶向控制炎癥相關基因功能的兩種調節因子,可使模型中的T細胞至少增加10倍,從而增強抗腫瘤免疫活性和持久性。

圖1 靶向控制炎癥相關基因功能的兩種調節因子可使模型中的T細胞至少增加10倍
CAR-T細胞療法由Carl H. June醫學博士首創,他是賓夕法尼亞大學免疫療法教授,也是Abramson癌癥中心細胞免疫療法(CCI)主任,他的工作導致了2017年首次批準用于B細胞急性淋巴細胞白血病的CAR - T細胞療法。從那時起,個性化細胞療法徹底改變了血癌的治療方法,但對肺癌和乳腺癌等實體腫瘤仍然無效。
對于這項新研究,June表示:“我們希望為實體瘤患者開啟CAR-T細胞療法,其中包括最常見的癌癥類型。我們的研究表明,免疫炎癥調節劑靶向(immune inflammatory regulator targeting)值得進一步研究,增強T細胞的效力。”
CAR-T細胞治療實體腫瘤的挑戰之一是一種被稱為T細胞衰竭的現象,即來自實體腫瘤細胞的持續抗原暴露使T細胞疲憊不堪,不能產生抗腫瘤反應。將病人體內已經耗盡的T細胞用于CAR - T細胞治療會導致效果較差,因為T細胞不能充分繁殖,也不能記住它們的任務。
先前的觀察性研究暗示,炎癥調節因子Regnase-1是間接克服T細胞衰竭影響的潛在靶點,因為當T細胞被破壞時,Regnase-1會引起過度炎癥,使它們復活以產生抗腫瘤反應。該論文一作David Mai博士,提出同時針對相關但獨立的Roquin-1調節器可以進一步促進反應。
Mai說:“這兩個調節基因中的每一個都涉及限制T細胞炎癥反應,但我們發現,將它們放在一起比單獨破壞它們產生更大的抗癌效果。在之前研究的基礎上,我們開始越來越接近在實體瘤環境下有前景的策略。”
該團隊使用CRISPR-Cas9基因編輯技術分別敲除Regnase-1和Roquin-1,并同時敲除健康供體T細胞中的兩種不同的免疫受體,目前正在I期臨床試驗中進行研究:間皮素靶向M5 CAR (mesoCAR)和NY-ESO-1靶向8F TCR (NYESO TCR)。這兩種工程T細胞產品都不是針對CD19的,因為這種抗原不存在于實體腫瘤中,而CD19是大多數被批準的CAR-T細胞療法靶向的抗原。

圖2 Regnase-1和Roquin-1雙敲除
在CRISPR編輯后,T細胞被擴增并注入實體瘤小鼠模型中,研究人員觀察到,與單獨禁用Regnase-1相比,雙重敲除導致至少10倍的工程T細胞,以及增加的抗腫瘤免疫活性和工程T細胞的壽命。在一些小鼠中,它還導致淋巴細胞產生過剩,導致毒性。
Sheppard說:“CRISPR是一種有用的工具,可以完全消除Regnase和Roquin等靶基因的表達,從而產生明確的表型,然而,還有其他策略可以考慮將這項工作轉化為臨床環境,例如條件基因調控的形式。”“我們當然對結合敲除這兩種非冗余蛋白質所釋放的抗腫瘤效力印象深刻。在實體腫瘤研究中,我們經常看到CAR - T細胞的有限擴張,但如果我們能夠使每個T細胞更有效,并大量復制它們,我們預計T細胞療法將有更好的機會攻擊實體腫瘤。”
其他作者還包括Omar Johnson, Jordan ref, Ting-Jia Fan和John Scholler。這項研究得到了美國國立衛生研究院(1P01CA214278, R01CA226983)、帕克癌癥免疫治療研究所、愛默生集體、方丹獎學金、諾曼和塞爾瑪·克倫研究獎學金以及羅伯特·伍德·約翰遜基金會衛生政策研究學者的支持。
參考資料:
[1] Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells



