摘要:匹茲堡大學的研究人員已經開發出一種通用受體系統,允許T細胞識別任何細胞表面目標。
匹茲堡大學的研究人員已經開發出一種通用受體系統,允許T細胞識別任何細胞表面目標,使高度定制的CAR - T細胞和其他免疫療法能夠治療癌癥和其他疾病。這一發現可能會擴展到實體腫瘤,并使更多的患者獲得CAR - T細胞療法在某些血癌中產生的改變游戲規則的結果。
5月9日發表在《Nature Communications 》雜志上的一項研究描述了這種新方法,它涉及到對T細胞進行工程化,使其受體帶有通用的“SNAPtag”,可以與針對不同蛋白質的抗體融合。通過調整這些抗體的類型或劑量,可以為最佳的免疫反應量身定制治療方法。

圖1 對T細胞進行工程化,使其受體帶有通用的“SNAPtag”
研究人員表明,他們的SNAP方法在兩個重要的受體中起作用:CAR受體,一種協調一系列免疫反應的合成T細胞受體,以及SynNotch,一種可以被編程激活幾乎任何基因的合成受體。隨著SNAP的加入,定制療法的可能性幾乎變得無窮無盡。
“我們首次展示了我們可以制造一種通用的SynNotch受體。這個SNAP-SynNotch系統是超級可編程的,因為你可以同時擁有設計輸入和設計基因輸出,”通訊作者Jason Lohmueller博士說。“我們的希望是,我們可以利用這種方法制造細胞療法,并為癌癥、自身免疫性疾病、器官移植耐受等提供基因。”
CAR - T細胞免疫療法包括改造患者自身的細胞,使T細胞受體在將癌細胞注入患者體內之前識別癌細胞上的特定蛋白質。
“CAR - T療法的一個大問題是你只針對一種蛋白質,”Lohmueller解釋說。“如果腫瘤發展到失去這種蛋白質或下調它,你就需要第二次重新設計T細胞,這是一個高度復雜和昂貴的過程。”
為了克服這個問題,Lohmueller、第一作者Elisa Ruffo博士、Alexander Deiters博士和他們的同事通過在CAR受體中添加SNAPtag酶,開發了通用的SNAP-CAR T細胞。這些細胞與癌癥靶向抗體一起使用,這些抗體被標記為一種叫做苯鳥嘌呤的分子。
通過一種生物正交化學——一種在生命系統中發生的不干擾自然過程的反應——SNAPtag與苯鳥嘌呤反應,將抗體融合到受體上。同時或依次添加不同的抗體,使受體能夠識別不同的腫瘤特征。
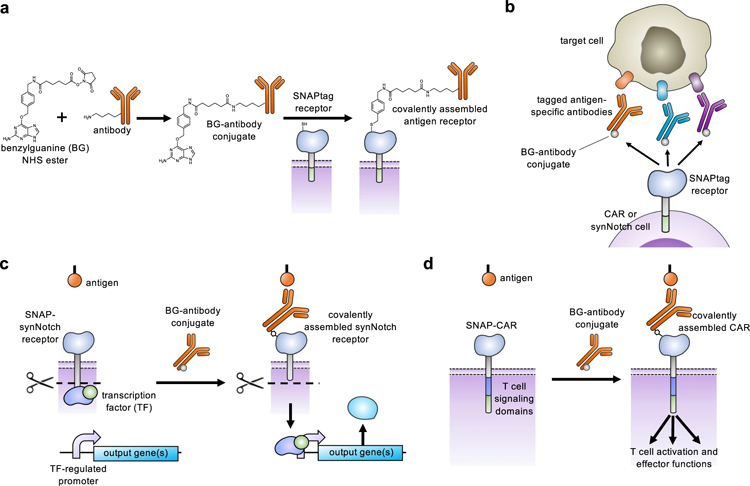
圖2 通用適配器SNAP-CAR和SNAP-synNotch受體功能
“我們方法的獨特之處在于T細胞如何與抗體相互作用。它不僅僅是結合,而且是通過共價附著——最強的化學鍵形式——融合,”Lohmueller解釋說。“這種生物正交方法已被證明可用于動物成像目的,但我們是首批將其用于治療的人之一,所以我們真的在推動共價技術的界限。”
Lohmueller說,這種緊密結合的一個優點是可以用較低劑量的抗體激活受體。研究生Adam Butchy和Natasa Miskov-Zivanov博士利用數學模型表明,也有可能從抗體和腫瘤細胞之間較弱的相互作用中獲得活性,從而為可靶向的癌癥蛋白類型提供更大的靈活性。
共價鍵也是創造SNAP-SynNotch細胞的秘密成分。當SynNotch受體被激活時,機械拉力拉伸受體以暴露部分蛋白質,然后將其切割以釋放轉錄因子,該轉錄因子進入細胞核,開啟選定基因的表達。
“我們發現我們需要共價鍵的強度來承受這種拉力,”Lohmueller解釋說。“如果我們只是在受體和抗體之間結合,受體就會分離,我們就不會得到信號。”
研究人員表明,他們的通用SNAP-CAR和SNAP-SynNotch受體可以通過添加相應的抗體來激活不同的靶標。SNAP-CAR T細胞還能夠同時靶向不同類型細胞上的多種蛋白質,這表明它們可以幫助避免由于腫瘤靶點的變化或這些靶點的喪失而導致的癌癥復發。
在小鼠癌癥模型中,SNAP-CAR T細胞治療縮小了腫瘤并大大延長了生存期,這是一個重要的概念驗證,為與Coeptis Therapeutics合作在臨床試驗中測試這種方法奠定了基礎,Coeptis Therapeutics從匹茲堡獲得了SNAP-CAR技術的許可。
參考資料:
[1] Post-translational covalent assembly of CAR and synNotch receptors for programmable antigen targeting
摘要:匹茲堡大學的研究人員已經開發出一種通用受體系統,允許T細胞識別任何細胞表面目標。
匹茲堡大學的研究人員已經開發出一種通用受體系統,允許T細胞識別任何細胞表面目標,使高度定制的CAR - T細胞和其他免疫療法能夠治療癌癥和其他疾病。這一發現可能會擴展到實體腫瘤,并使更多的患者獲得CAR - T細胞療法在某些血癌中產生的改變游戲規則的結果。
5月9日發表在《Nature Communications 》雜志上的一項研究描述了這種新方法,它涉及到對T細胞進行工程化,使其受體帶有通用的“SNAPtag”,可以與針對不同蛋白質的抗體融合。通過調整這些抗體的類型或劑量,可以為最佳的免疫反應量身定制治療方法。

圖1 對T細胞進行工程化,使其受體帶有通用的“SNAPtag”
研究人員表明,他們的SNAP方法在兩個重要的受體中起作用:CAR受體,一種協調一系列免疫反應的合成T細胞受體,以及SynNotch,一種可以被編程激活幾乎任何基因的合成受體。隨著SNAP的加入,定制療法的可能性幾乎變得無窮無盡。
“我們首次展示了我們可以制造一種通用的SynNotch受體。這個SNAP-SynNotch系統是超級可編程的,因為你可以同時擁有設計輸入和設計基因輸出,”通訊作者Jason Lohmueller博士說。“我們的希望是,我們可以利用這種方法制造細胞療法,并為癌癥、自身免疫性疾病、器官移植耐受等提供基因。”
CAR - T細胞免疫療法包括改造患者自身的細胞,使T細胞受體在將癌細胞注入患者體內之前識別癌細胞上的特定蛋白質。
“CAR - T療法的一個大問題是你只針對一種蛋白質,”Lohmueller解釋說。“如果腫瘤發展到失去這種蛋白質或下調它,你就需要第二次重新設計T細胞,這是一個高度復雜和昂貴的過程。”
為了克服這個問題,Lohmueller、第一作者Elisa Ruffo博士、Alexander Deiters博士和他們的同事通過在CAR受體中添加SNAPtag酶,開發了通用的SNAP-CAR T細胞。這些細胞與癌癥靶向抗體一起使用,這些抗體被標記為一種叫做苯鳥嘌呤的分子。
通過一種生物正交化學——一種在生命系統中發生的不干擾自然過程的反應——SNAPtag與苯鳥嘌呤反應,將抗體融合到受體上。同時或依次添加不同的抗體,使受體能夠識別不同的腫瘤特征。

圖2 通用適配器SNAP-CAR和SNAP-synNotch受體功能
“我們方法的獨特之處在于T細胞如何與抗體相互作用。它不僅僅是結合,而且是通過共價附著——最強的化學鍵形式——融合,”Lohmueller解釋說。“這種生物正交方法已被證明可用于動物成像目的,但我們是首批將其用于治療的人之一,所以我們真的在推動共價技術的界限。”
Lohmueller說,這種緊密結合的一個優點是可以用較低劑量的抗體激活受體。研究生Adam Butchy和Natasa Miskov-Zivanov博士利用數學模型表明,也有可能從抗體和腫瘤細胞之間較弱的相互作用中獲得活性,從而為可靶向的癌癥蛋白類型提供更大的靈活性。
共價鍵也是創造SNAP-SynNotch細胞的秘密成分。當SynNotch受體被激活時,機械拉力拉伸受體以暴露部分蛋白質,然后將其切割以釋放轉錄因子,該轉錄因子進入細胞核,開啟選定基因的表達。
“我們發現我們需要共價鍵的強度來承受這種拉力,”Lohmueller解釋說。“如果我們只是在受體和抗體之間結合,受體就會分離,我們就不會得到信號。”
研究人員表明,他們的通用SNAP-CAR和SNAP-SynNotch受體可以通過添加相應的抗體來激活不同的靶標。SNAP-CAR T細胞還能夠同時靶向不同類型細胞上的多種蛋白質,這表明它們可以幫助避免由于腫瘤靶點的變化或這些靶點的喪失而導致的癌癥復發。
在小鼠癌癥模型中,SNAP-CAR T細胞治療縮小了腫瘤并大大延長了生存期,這是一個重要的概念驗證,為與Coeptis Therapeutics合作在臨床試驗中測試這種方法奠定了基礎,Coeptis Therapeutics從匹茲堡獲得了SNAP-CAR技術的許可。
參考資料:
[1] Post-translational covalent assembly of CAR and synNotch receptors for programmable antigen targeting



