摘要:在皮膚中,一些異常的成人表皮干細胞開啟SOX9,啟動一個最終激活癌癥基因的過程。
在早期,每個干細胞都面臨著一個決定命運的選擇。例如,在皮膚發育過程中,胚胎表皮開始為單層表皮祖細胞。它們的選擇是變成成熟的表皮細胞,還是變成毛囊細胞。這種所謂的命運開關是由轉錄因子SOX9控制的。如果祖細胞表達SOX9,毛囊細胞發育。如果沒有,表皮細胞有。
但SOX9也有陰暗的一面,因為它與世界上許多最致命的癌癥有關,包括肺癌、皮膚癌、頭頸癌和骨癌。在皮膚中,一些異常的成年表皮干細胞后來會開啟SOX9,盡管它們選擇了一條通路——而且永遠不會關閉它,從而啟動一個最終激活癌癥基因的過程。
科學家們從來沒有完全理解這種注定的結果是如何在分子水平上發生的。但現在洛克菲勒的研究人員已經揭示了這一惡性轉變背后的機制。事實證明,SOX9屬于一類特殊的蛋白質,它控制著遺傳信息從DNA到mRNA的傳遞。這意味著它有能力撬開密封的遺傳物質口袋,與之前沉默的基因結合,并激活它們。他們的研究結果發表在《自然細胞生物學》雜志上。
圖1 研究發現SOX9控制著遺傳信息從DNA到mRNA的傳遞
Robin Chemers Neustein哺乳動物細胞生物學和發育實驗室的負責人Elaine Fuchs說:“我們的發現為癌癥如何破壞干細胞精心調整的決策過程提供了新的見解,此后使其不可能形成正常組織。”“它還闡明了新的sox9激活基因是潛在的治療靶點。”
基因表達的罕見鑰匙
我們的基因組不是一本公開的書。事實上,它更像是一個圖書館,里面有幾十億本書,大部分都被鎖上了鑰匙——大多數遺傳物質實際上都隱藏在非編碼和緊密結合的DNA包里,這些DNA包被組蛋白以封閉狀態封鎖起來。DNA和組蛋白一起形成了所謂的封閉染色質。被包裹在這種封閉物質中的基因無法被轉錄蛋白或因子所接觸,而轉錄蛋白或因子則有助于表達其中的基因。
但也有一些罕見的鍵不是簡單的轉錄因子。這些“先鋒因素”可以解開這些基因包。它們具有窺探封閉染色質內部并識別其結合位點的超能力。然后,它們招募其他轉錄因子來幫助它們撬開封閉的染色質,并與核小體上的受體位點結合,從而重新編程染色質并激活新的基因。
這通常發生在發育的早期階段,當時干細胞的命運尚未確定。在成人皮膚中,SOX9通常與維持成人毛囊干細胞的身份有關。它通常在成人表皮干細胞中被抑制。但對于基底細胞癌和鱗狀細胞癌,情況并非如此。
“在疾病背景下,SOX9在成人表皮干細胞中被重新激活,”該研究的第一作者Yihao Yang說。
他說,這個過程是如何一步步展開的還不得而知。“體外重編程發生得非常快——在48小時內。在如此短的時間窗口內,很難對事件的順序進行很好的解決。
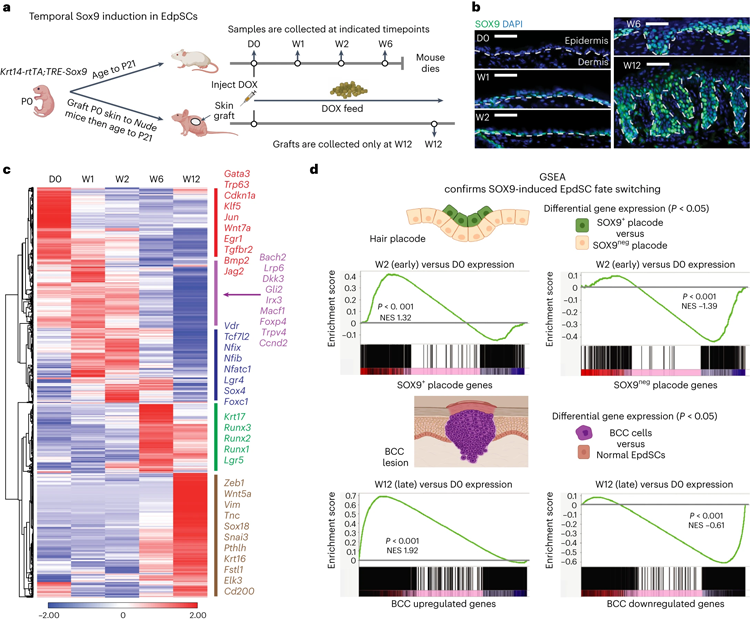
圖2 持續的SOX9再激活使表皮沉默,同時激活毛囊,隨后導致BCC死亡
SOX9交換
為了找到答案,研究人員設計了含有SOX9拷貝的小鼠,當小鼠被喂食強力霉素(一種誘導轉基因SOX9的藥物)時,SOX9拷貝可以在它們的成年表皮干細胞中被激活。
“在成體組織中,在胚胎發生時容易做出的選擇被嚴格抑制,這樣成體干細胞就能堅持自己的任務,”Fuchs解釋說。
然而,釋放SOX9被證明是一個強有力的影響因素,逐漸將表皮干細胞重新編程到新的命運。Yang說:“僅通過表達這種單一的SOX9轉錄因子,我們就能夠在第6周誘導基底細胞癌樣結構。到第12周,我們開始看到類似人類基底細胞癌的病變。”
同時,他們追蹤了在幕后發生的表觀遺傳過程。在頭兩周,SOX9關閉了表皮干細胞基因。它們開始逆轉正常狀態,開啟毛囊干細胞基因。
在尋找機制的過程中,研究人員發現,為了實現這種命運的轉換,SOX9從活躍的表皮基因中劫持了核機器,并將這種竊取的設備帶到沉默的毛囊基因中。然后,它利用其他轉錄因子撬開與內部沉默基因結合的封閉染色質,使它們啟動。
Fuchs說:“當SOX9不能被調節時,干細胞不能長出毛發,而是繼續增殖并激活幾種新的轉錄因子,最終導致基底細胞癌狀態。”
這種復雜的、身份轉換的來回轉換之所以成為可能,是因為SOX9是一個先鋒因素。“只有先驅者因子才有能力接近封閉的染色質,”他指出。
由于SOX9在世界上許多最致命的癌癥中過度活躍,研究人員的目標是尋找干預其在這些細胞增殖中的作用的方法。“通過確定SOX9的相互作用蛋白及其靶基因在惡性腫瘤期間是如何變化的,我們希望在發現這些癌癥的新藥物靶點方面取得進展。”
參考資料:
[1] Yihao Yang, Nicholas Gomez, Nicole Infarinato, Rene C. Adam, Megan Sribour, Inwha Baek, Mélanie Laurin, Elaine Fuchs. The pioneer factor SOX9 competes for epigenetic factors to switch stem cell fates. Nature Cell Biology, 2023; DOI: 10.1038/s41556-023-01184-y
摘要:在皮膚中,一些異常的成人表皮干細胞開啟SOX9,啟動一個最終激活癌癥基因的過程。
在早期,每個干細胞都面臨著一個決定命運的選擇。例如,在皮膚發育過程中,胚胎表皮開始為單層表皮祖細胞。它們的選擇是變成成熟的表皮細胞,還是變成毛囊細胞。這種所謂的命運開關是由轉錄因子SOX9控制的。如果祖細胞表達SOX9,毛囊細胞發育。如果沒有,表皮細胞有。
但SOX9也有陰暗的一面,因為它與世界上許多最致命的癌癥有關,包括肺癌、皮膚癌、頭頸癌和骨癌。在皮膚中,一些異常的成年表皮干細胞后來會開啟SOX9,盡管它們選擇了一條通路——而且永遠不會關閉它,從而啟動一個最終激活癌癥基因的過程。
科學家們從來沒有完全理解這種注定的結果是如何在分子水平上發生的。但現在洛克菲勒的研究人員已經揭示了這一惡性轉變背后的機制。事實證明,SOX9屬于一類特殊的蛋白質,它控制著遺傳信息從DNA到mRNA的傳遞。這意味著它有能力撬開密封的遺傳物質口袋,與之前沉默的基因結合,并激活它們。他們的研究結果發表在《自然細胞生物學》雜志上。

圖1 研究發現SOX9控制著遺傳信息從DNA到mRNA的傳遞
Robin Chemers Neustein哺乳動物細胞生物學和發育實驗室的負責人Elaine Fuchs說:“我們的發現為癌癥如何破壞干細胞精心調整的決策過程提供了新的見解,此后使其不可能形成正常組織。”“它還闡明了新的sox9激活基因是潛在的治療靶點。”
基因表達的罕見鑰匙
我們的基因組不是一本公開的書。事實上,它更像是一個圖書館,里面有幾十億本書,大部分都被鎖上了鑰匙——大多數遺傳物質實際上都隱藏在非編碼和緊密結合的DNA包里,這些DNA包被組蛋白以封閉狀態封鎖起來。DNA和組蛋白一起形成了所謂的封閉染色質。被包裹在這種封閉物質中的基因無法被轉錄蛋白或因子所接觸,而轉錄蛋白或因子則有助于表達其中的基因。
但也有一些罕見的鍵不是簡單的轉錄因子。這些“先鋒因素”可以解開這些基因包。它們具有窺探封閉染色質內部并識別其結合位點的超能力。然后,它們招募其他轉錄因子來幫助它們撬開封閉的染色質,并與核小體上的受體位點結合,從而重新編程染色質并激活新的基因。
這通常發生在發育的早期階段,當時干細胞的命運尚未確定。在成人皮膚中,SOX9通常與維持成人毛囊干細胞的身份有關。它通常在成人表皮干細胞中被抑制。但對于基底細胞癌和鱗狀細胞癌,情況并非如此。
“在疾病背景下,SOX9在成人表皮干細胞中被重新激活,”該研究的第一作者Yihao Yang說。
他說,這個過程是如何一步步展開的還不得而知。“體外重編程發生得非常快——在48小時內。在如此短的時間窗口內,很難對事件的順序進行很好的解決。

圖2 持續的SOX9再激活使表皮沉默,同時激活毛囊,隨后導致BCC死亡
SOX9交換
為了找到答案,研究人員設計了含有SOX9拷貝的小鼠,當小鼠被喂食強力霉素(一種誘導轉基因SOX9的藥物)時,SOX9拷貝可以在它們的成年表皮干細胞中被激活。
“在成體組織中,在胚胎發生時容易做出的選擇被嚴格抑制,這樣成體干細胞就能堅持自己的任務,”Fuchs解釋說。
然而,釋放SOX9被證明是一個強有力的影響因素,逐漸將表皮干細胞重新編程到新的命運。Yang說:“僅通過表達這種單一的SOX9轉錄因子,我們就能夠在第6周誘導基底細胞癌樣結構。到第12周,我們開始看到類似人類基底細胞癌的病變。”
同時,他們追蹤了在幕后發生的表觀遺傳過程。在頭兩周,SOX9關閉了表皮干細胞基因。它們開始逆轉正常狀態,開啟毛囊干細胞基因。
在尋找機制的過程中,研究人員發現,為了實現這種命運的轉換,SOX9從活躍的表皮基因中劫持了核機器,并將這種竊取的設備帶到沉默的毛囊基因中。然后,它利用其他轉錄因子撬開與內部沉默基因結合的封閉染色質,使它們啟動。
Fuchs說:“當SOX9不能被調節時,干細胞不能長出毛發,而是繼續增殖并激活幾種新的轉錄因子,最終導致基底細胞癌狀態。”
這種復雜的、身份轉換的來回轉換之所以成為可能,是因為SOX9是一個先鋒因素。“只有先驅者因子才有能力接近封閉的染色質,”他指出。
由于SOX9在世界上許多最致命的癌癥中過度活躍,研究人員的目標是尋找干預其在這些細胞增殖中的作用的方法。“通過確定SOX9的相互作用蛋白及其靶基因在惡性腫瘤期間是如何變化的,我們希望在發現這些癌癥的新藥物靶點方面取得進展。”
參考資料:
[1] Yihao Yang, Nicholas Gomez, Nicole Infarinato, Rene C. Adam, Megan Sribour, Inwha Baek, Mélanie Laurin, Elaine Fuchs. The pioneer factor SOX9 competes for epigenetic factors to switch stem cell fates. Nature Cell Biology, 2023; DOI: 10.1038/s41556-023-01184-y



