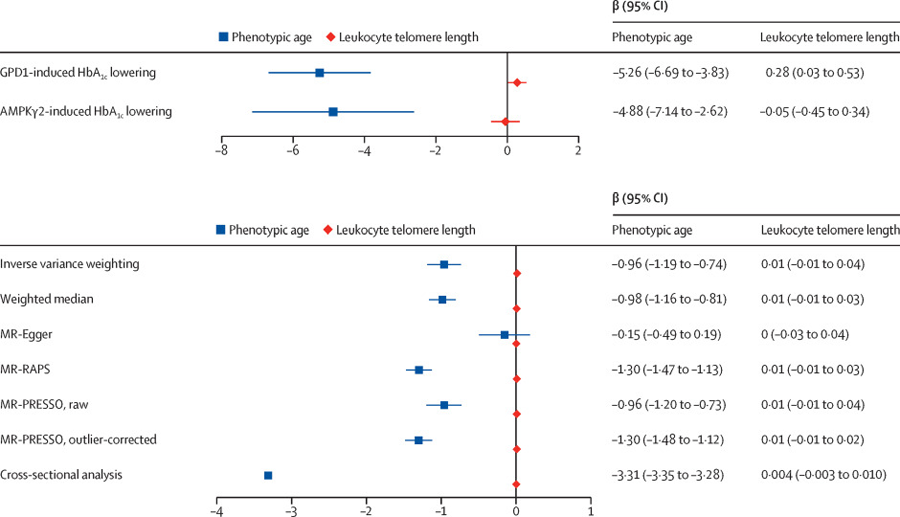
摘要:丹麥奧胡斯大學(xué)的研究人員近日利用CRISPR-Cas9系統(tǒng)開發(fā)出一種基因療法,可以阻止這種侵襲性AML亞型的細(xì)胞分裂
急性髓系白血病(AML)是成年人最常見的急性白血病,其特點(diǎn)是大量異常分化的髓系細(xì)胞發(fā)生不可控制的增殖。部分癌癥是由細(xì)胞分裂過程中的不同基因融合引起的。這種融合導(dǎo)致細(xì)胞生長(zhǎng)不受控制。
丹麥奧胡斯大學(xué)的研究人員近日利用CRISPR-Cas9系統(tǒng)開發(fā)出一種基因療法,可以阻止這種侵襲性AML亞型的細(xì)胞分裂,為AML的治療提供了一種很有前景的治療方法。
這項(xiàng)研究成果于近日發(fā)表在《Leukemia》雜志上。盡管這項(xiàng)研究的重點(diǎn)是血液癌癥,但其他許多類型的癌癥也是由融合基因驅(qū)動(dòng)的,如部分肺癌和肉瘤。故研究人員推測(cè),這項(xiàng)技術(shù)可以成為一種平臺(tái)技術(shù),用于治療由基因融合驅(qū)動(dòng)的特定癌癥類型。

圖1 利用CRISPR-Cas9系統(tǒng)開發(fā)出一種基因療法
簡(jiǎn)單地說(shuō),研究人員成功地打斷了驅(qū)動(dòng)癌癥的融合基因,這些基因錯(cuò)誤地融合在一起,并向細(xì)胞發(fā)送致命信號(hào),使細(xì)胞開始不受控制地分裂。當(dāng)融合基因被打斷時(shí),癌細(xì)胞就會(huì)停止分裂。到目前為止,他們已在細(xì)胞系和小鼠身上試驗(yàn)了這種基因療法。
在實(shí)驗(yàn)室環(huán)境下,他們采用電穿孔的方式將Cas9酶和向?qū)NA導(dǎo)入細(xì)胞。“你可以在實(shí)驗(yàn)室中使用這種方法,但不能在患者身上使用。我們需要研究如何將Cas9酶和向?qū)NA同時(shí)送入癌細(xì)胞,”奧胡斯大學(xué)臨床醫(yī)學(xué)系副教授Maja Ludvigsen說(shuō)。
他補(bǔ)充說(shuō),作者們已經(jīng)在一項(xiàng)平行研究中使用脂肪顆粒作為遞送載體。作為COVID-19的mRNA疫苗的遞送策略,這種方法非常有效。
研究人員將帶有基因融合的癌細(xì)胞植入小鼠的兩側(cè)。未經(jīng)處理的細(xì)胞系長(zhǎng)成了巨大的腫瘤,而細(xì)胞經(jīng)過處理后,也就是在植入小鼠體內(nèi)之前接受過基因治療,腫瘤要小得多,或者根本沒有腫瘤。
“我們的基因療法在實(shí)驗(yàn)室中似乎非常有效。我們不知道這種療法是否足夠有效,可應(yīng)對(duì)所有的癌細(xì)胞。但在癌癥研究領(lǐng)域有一個(gè)假設(shè),如果一種治療方法能夠靶向大多數(shù)癌細(xì)胞,那么剩下的就交給免疫系統(tǒng),” Maja Ludvigsen說(shuō)。
研究人員的下一個(gè)任務(wù)是證明采用最佳遞送策略的治療方法也適用于帶有特定基因融合的白血病小鼠。
雙內(nèi)含子靶向CRISPR-Cas9介導(dǎo)RUNX1-RUNX1T1的破壞
他們還將研究這種治療策略對(duì)于其他的融合驅(qū)動(dòng)型癌癥來(lái)說(shuō)是否是一種更好的治療選擇。不過他們?nèi)杂幸欢温芬摺@纾芯咳藛T還不知道這種基因療法的潛在副作用。
“挑戰(zhàn)之一在于,如果我們能夠在癌細(xì)胞中切割DNA,那么我們也會(huì)在其他健康細(xì)胞中切割相同的染色體。由于融合基因不存在于健康細(xì)胞中,我們的理論是健康細(xì)胞可以自己修復(fù)DNA,不過,我們必須對(duì)此進(jìn)行更深入的研究,”Maja Ludvigsen解釋說(shuō)。
這項(xiàng)研究成果代表了人們朝著了解和治療融合驅(qū)動(dòng)型癌癥邁出了重要一步。“雖然仍然處于轉(zhuǎn)化研究階段,但這是一個(gè)突破,因?yàn)槲覀円呀?jīng)成功地使用CRISPR/Cas9技術(shù)對(duì)驅(qū)動(dòng)癌癥的特定融合基因進(jìn)行靶向治療,”Maja Ludvigsen說(shuō),他希望五年內(nèi)可以開始臨床試驗(yàn)。
“盡管未來(lái)還有很多工作要做,但這一結(jié)果給那些機(jī)會(huì)有限的患者帶來(lái)了治療的希望。未來(lái),我希望我們能夠推出一種更溫和、更有效且沒有嚴(yán)重副作用的治療方法,”Maja Ludvigsen說(shuō)。
參考資料:
[1] Neldeborg, S., Soerensen, J.F., M?ller, C.T. et al. Dual intron-targeted CRISPR-Cas9-mediated disruption of the AML RUNX1-RUNX1T1 fusion gene effectively inhibits proliferation and decreases tumor volume in vitro and in vivo. Leukemia (2023). https://doi.org/10.1038/s41375-023-01950-9
摘要:丹麥奧胡斯大學(xué)的研究人員近日利用CRISPR-Cas9系統(tǒng)開發(fā)出一種基因療法,可以阻止這種侵襲性AML亞型的細(xì)胞分裂
急性髓系白血病(AML)是成年人最常見的急性白血病,其特點(diǎn)是大量異常分化的髓系細(xì)胞發(fā)生不可控制的增殖。部分癌癥是由細(xì)胞分裂過程中的不同基因融合引起的。這種融合導(dǎo)致細(xì)胞生長(zhǎng)不受控制。
丹麥奧胡斯大學(xué)的研究人員近日利用CRISPR-Cas9系統(tǒng)開發(fā)出一種基因療法,可以阻止這種侵襲性AML亞型的細(xì)胞分裂,為AML的治療提供了一種很有前景的治療方法。
這項(xiàng)研究成果于近日發(fā)表在《Leukemia》雜志上。盡管這項(xiàng)研究的重點(diǎn)是血液癌癥,但其他許多類型的癌癥也是由融合基因驅(qū)動(dòng)的,如部分肺癌和肉瘤。故研究人員推測(cè),這項(xiàng)技術(shù)可以成為一種平臺(tái)技術(shù),用于治療由基因融合驅(qū)動(dòng)的特定癌癥類型。

圖1 利用CRISPR-Cas9系統(tǒng)開發(fā)出一種基因療法
簡(jiǎn)單地說(shuō),研究人員成功地打斷了驅(qū)動(dòng)癌癥的融合基因,這些基因錯(cuò)誤地融合在一起,并向細(xì)胞發(fā)送致命信號(hào),使細(xì)胞開始不受控制地分裂。當(dāng)融合基因被打斷時(shí),癌細(xì)胞就會(huì)停止分裂。到目前為止,他們已在細(xì)胞系和小鼠身上試驗(yàn)了這種基因療法。
在實(shí)驗(yàn)室環(huán)境下,他們采用電穿孔的方式將Cas9酶和向?qū)NA導(dǎo)入細(xì)胞。“你可以在實(shí)驗(yàn)室中使用這種方法,但不能在患者身上使用。我們需要研究如何將Cas9酶和向?qū)NA同時(shí)送入癌細(xì)胞,”奧胡斯大學(xué)臨床醫(yī)學(xué)系副教授Maja Ludvigsen說(shuō)。
他補(bǔ)充說(shuō),作者們已經(jīng)在一項(xiàng)平行研究中使用脂肪顆粒作為遞送載體。作為COVID-19的mRNA疫苗的遞送策略,這種方法非常有效。
研究人員將帶有基因融合的癌細(xì)胞植入小鼠的兩側(cè)。未經(jīng)處理的細(xì)胞系長(zhǎng)成了巨大的腫瘤,而細(xì)胞經(jīng)過處理后,也就是在植入小鼠體內(nèi)之前接受過基因治療,腫瘤要小得多,或者根本沒有腫瘤。
“我們的基因療法在實(shí)驗(yàn)室中似乎非常有效。我們不知道這種療法是否足夠有效,可應(yīng)對(duì)所有的癌細(xì)胞。但在癌癥研究領(lǐng)域有一個(gè)假設(shè),如果一種治療方法能夠靶向大多數(shù)癌細(xì)胞,那么剩下的就交給免疫系統(tǒng),” Maja Ludvigsen說(shuō)。
研究人員的下一個(gè)任務(wù)是證明采用最佳遞送策略的治療方法也適用于帶有特定基因融合的白血病小鼠。

雙內(nèi)含子靶向CRISPR-Cas9介導(dǎo)RUNX1-RUNX1T1的破壞
他們還將研究這種治療策略對(duì)于其他的融合驅(qū)動(dòng)型癌癥來(lái)說(shuō)是否是一種更好的治療選擇。不過他們?nèi)杂幸欢温芬摺@纾芯咳藛T還不知道這種基因療法的潛在副作用。
“挑戰(zhàn)之一在于,如果我們能夠在癌細(xì)胞中切割DNA,那么我們也會(huì)在其他健康細(xì)胞中切割相同的染色體。由于融合基因不存在于健康細(xì)胞中,我們的理論是健康細(xì)胞可以自己修復(fù)DNA,不過,我們必須對(duì)此進(jìn)行更深入的研究,”Maja Ludvigsen解釋說(shuō)。
這項(xiàng)研究成果代表了人們朝著了解和治療融合驅(qū)動(dòng)型癌癥邁出了重要一步。“雖然仍然處于轉(zhuǎn)化研究階段,但這是一個(gè)突破,因?yàn)槲覀円呀?jīng)成功地使用CRISPR/Cas9技術(shù)對(duì)驅(qū)動(dòng)癌癥的特定融合基因進(jìn)行靶向治療,”Maja Ludvigsen說(shuō),他希望五年內(nèi)可以開始臨床試驗(yàn)。
“盡管未來(lái)還有很多工作要做,但這一結(jié)果給那些機(jī)會(huì)有限的患者帶來(lái)了治療的希望。未來(lái),我希望我們能夠推出一種更溫和、更有效且沒有嚴(yán)重副作用的治療方法,”Maja Ludvigsen說(shuō)。
參考資料:
[1] Neldeborg, S., Soerensen, J.F., M?ller, C.T. et al. Dual intron-targeted CRISPR-Cas9-mediated disruption of the AML RUNX1-RUNX1T1 fusion gene effectively inhibits proliferation and decreases tumor volume in vitro and in vivo. Leukemia (2023). https://doi.org/10.1038/s41375-023-01950-9



