摘要:研究人員發現,不同的常駐共生腸道細菌群落通過消耗病原體在宿主中站穩腳跟所需的營養物質,共同保護人類腸道免受致病微生物的侵害。
牛津大學領導的一項研究發現,不同的常駐共生腸道細菌群落通過消耗病原體在宿主體內站穩腳跟所需的營養物質,共同保護人類腸道免受致病微生物的侵害。
該研究小組采用生態學方法研究了兩種主要病原菌——肺炎克雷伯菌和傷寒沙門氏菌(S. Typhimurium)——的定植是如何受到一系列人類腸道細菌在體外和非生物小鼠體內的影響的。他們發現,微生物組的生態多樣性對抗定植很重要。雖然單獨一種腸道微生物群對提供對病原體的有效抵抗力的影響可以忽略不計,但不同群落中必要關鍵物種的某些組合在一起時表現出更大的定植抗性。
發現這些群落通過消耗病原體所需的營養物質來阻止病原體的生長,研究小組還表明,營養物質阻斷的概念可以用來預測特定的共生微生物群,這些微生物群可以單獨使用基因組序列數據來抵抗新的細菌病原體。
他們的綜合發現強調了為什么微生物組多樣性對人類健康很重要,并可能指出優化腸道健康的新策略的發展,以及合理設計耐病原體的微生物組群落。牛津大學生物和生物化學系的研究負責人Kevin Foster博士及其同事在《Science》雜志上發表了一篇題為《微生物組多樣性通過營養阻斷來抵御病原體》的論文。

圖1 微生物組多樣性通過營養阻斷來抵御病原體
人類腸道是多種共生細菌群落的家園,統稱為腸道微生物群。這些群落提供的一個主要健康益處是保護腸道免受可能導致有害感染的入侵病原體(致病微生物)的侵害。腸道菌群提供的一個主要健康益處是防止病原體定植和隨后的感染,這種現象被稱為抗殖民化。
然而,雖然微生物群對定植抗性的重要性是眾所周知的,但微生物群是一個非常多樣化和復雜的生態系統,這種復雜性使得了解哪些細菌物種和相互作用驅動對給定病原體的定植抗性成為一個真正的挑戰。到目前為止,人們還不清楚這種保護作用是如何產生的,以及某些細菌物種是否比其他細菌更重要。“盡管微生物群對定植抗性的重要性是明確的,但我們目前缺乏預測所需的原則,先驗地預測哪些微生物群物種將對給定的病原體有效,”研究人員繼續說。“組成物種也可以相互影響,并以對抗殖民化至關重要的方式在生態上相互作用。這種物種多樣性和潛在的生態相互作用的結合使定植抗性成為一種具有挑戰性的表型。”
為了進一步研究腸道菌群是如何以及哪些菌群能夠抵御微生物病原體,牛津大學的研究人員對100種不同的腸道細菌菌株進行了單獨和組合測試,以了解它們限制兩種有害細菌病原體——肺炎克雷伯菌和腸炎沙門氏菌——生長的能力。結果表明,雖然單個腸道細菌對任何一種病原體的傳播限制能力非常差,但當多達50種細菌的群落一起培養時,病原體的生長效率比任何單個物種培養時低1000倍。
無論細菌是在小瓶中一起培養,還是在實驗開始時沒有常駐腸道細菌的“無菌”無菌小鼠中培養,都可以看到這種“社區保護效應”。Foster說:“這些結果清楚地表明,抗定植是微生物群落的集體屬性。換句話說,一種菌株只有在與其他菌株結合使用時才具有保護作用。”
然而,研究人員發現,細菌群落的特定成員——而不僅僅是整體多樣性——對保護水平有關鍵影響。某些微生物物種被發現對以社區為基礎的保護至關重要,盡管這些物種本身提供的保護很少。
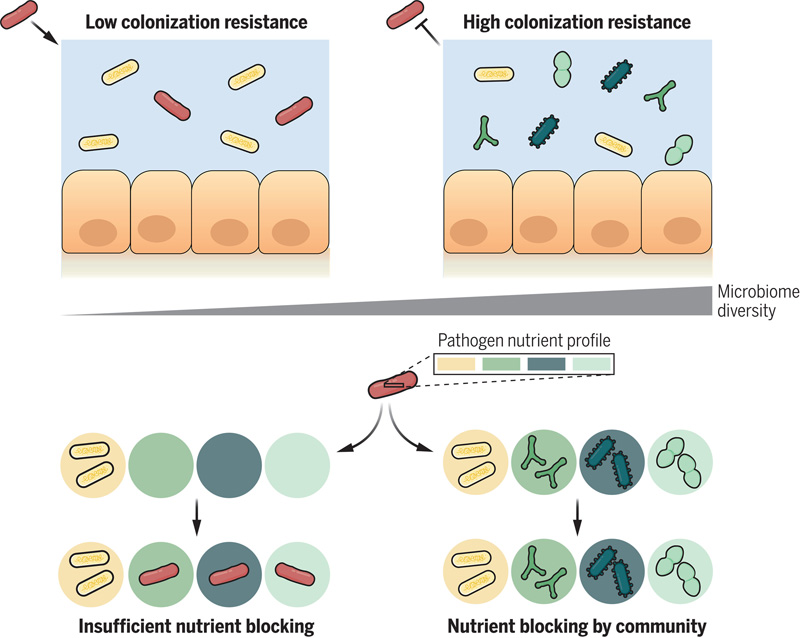
圖2 隨著微生物組多樣性的增加,不同營養素被消耗的可能性增加
研究人員證明,保護性細菌群落通過消耗病原體所需的營養物質來阻止病原體的生長。正如他們在報告中所寫的那樣,“盡管如此復雜,我們發現這些生態模式可以用一個簡單的基本原則來解釋:某些群落消耗營養和阻止病原體生長的集體能力。營養阻斷效應是整個群落的特性,而不是任何一個物種的特性。抗殖民化是一種社區水平的特征,這解釋了我們在實驗中觀察到的生態多樣性和復雜性的重要性。”
通過評估不同細菌物種的基因組,科學家們還發現,最具保護性的群落是由與致病物種具有高度相似蛋白質組成的物種組成的。“我們的基因組分析表明,在編碼功能上與病原體高度重疊的群落提供了最好的定植抗性,”他們評論道。
代謝分析表明,保護物種對碳源的需求與病原體相似。研究小組繼續說:“只有當群落在碳源利用方面與病原體有足夠高的重疊時,才會觀察到定植抗性。此外,與病原體代謝重疊最多的群落提供了最大的定植抗性。”
牛津大學生物和生物化學系的第一作者Frances Spragge評論說:“至關重要的是,盡管微生物組多樣性的增加增加了抵御這些病原體的可能性,但微生物群落和病原體之間營養利用譜的重疊是關鍵。某些在群落保護中起關鍵作用的物種與病原體表現出高度的代謝重疊,因此也有相似的營養需求。”
研究人員利用這種營養阻斷原理來預測細菌群落,這些細菌群落將對抗微生物藥物耐藥性(AMR)的大腸桿菌菌株提供弱保護和強保護。在實驗測試中,與大腸桿菌菌株具有最高營養重疊的群落在減少病原體豐度方面的效果是預計提供弱保護的群落的100倍。他們寫道:“我們運用我們的發現成功地預測了抵抗一種新的目標菌株的群落。”
根據研究人員的說法,這些新的見解可以通過優化腸道微生物群落發展成對抗有害腸道病原體的新策略。這一發現也可以解釋為什么個體在接受抗生素治療后更容易感染肺炎克雷伯菌等物種,因為抗生素治療可以降低腸道微生物群物種的多樣性。
參考資料
[1] Microbiome diversity protects against pathogens by nutrient blocking.
摘要:研究人員發現,不同的常駐共生腸道細菌群落通過消耗病原體在宿主中站穩腳跟所需的營養物質,共同保護人類腸道免受致病微生物的侵害。
牛津大學領導的一項研究發現,不同的常駐共生腸道細菌群落通過消耗病原體在宿主體內站穩腳跟所需的營養物質,共同保護人類腸道免受致病微生物的侵害。
該研究小組采用生態學方法研究了兩種主要病原菌——肺炎克雷伯菌和傷寒沙門氏菌(S. Typhimurium)——的定植是如何受到一系列人類腸道細菌在體外和非生物小鼠體內的影響的。他們發現,微生物組的生態多樣性對抗定植很重要。雖然單獨一種腸道微生物群對提供對病原體的有效抵抗力的影響可以忽略不計,但不同群落中必要關鍵物種的某些組合在一起時表現出更大的定植抗性。
發現這些群落通過消耗病原體所需的營養物質來阻止病原體的生長,研究小組還表明,營養物質阻斷的概念可以用來預測特定的共生微生物群,這些微生物群可以單獨使用基因組序列數據來抵抗新的細菌病原體。
他們的綜合發現強調了為什么微生物組多樣性對人類健康很重要,并可能指出優化腸道健康的新策略的發展,以及合理設計耐病原體的微生物組群落。牛津大學生物和生物化學系的研究負責人Kevin Foster博士及其同事在《Science》雜志上發表了一篇題為《微生物組多樣性通過營養阻斷來抵御病原體》的論文。

圖1 微生物組多樣性通過營養阻斷來抵御病原體
人類腸道是多種共生細菌群落的家園,統稱為腸道微生物群。這些群落提供的一個主要健康益處是保護腸道免受可能導致有害感染的入侵病原體(致病微生物)的侵害。腸道菌群提供的一個主要健康益處是防止病原體定植和隨后的感染,這種現象被稱為抗殖民化。
然而,雖然微生物群對定植抗性的重要性是眾所周知的,但微生物群是一個非常多樣化和復雜的生態系統,這種復雜性使得了解哪些細菌物種和相互作用驅動對給定病原體的定植抗性成為一個真正的挑戰。到目前為止,人們還不清楚這種保護作用是如何產生的,以及某些細菌物種是否比其他細菌更重要。“盡管微生物群對定植抗性的重要性是明確的,但我們目前缺乏預測所需的原則,先驗地預測哪些微生物群物種將對給定的病原體有效,”研究人員繼續說。“組成物種也可以相互影響,并以對抗殖民化至關重要的方式在生態上相互作用。這種物種多樣性和潛在的生態相互作用的結合使定植抗性成為一種具有挑戰性的表型。”
為了進一步研究腸道菌群是如何以及哪些菌群能夠抵御微生物病原體,牛津大學的研究人員對100種不同的腸道細菌菌株進行了單獨和組合測試,以了解它們限制兩種有害細菌病原體——肺炎克雷伯菌和腸炎沙門氏菌——生長的能力。結果表明,雖然單個腸道細菌對任何一種病原體的傳播限制能力非常差,但當多達50種細菌的群落一起培養時,病原體的生長效率比任何單個物種培養時低1000倍。
無論細菌是在小瓶中一起培養,還是在實驗開始時沒有常駐腸道細菌的“無菌”無菌小鼠中培養,都可以看到這種“社區保護效應”。Foster說:“這些結果清楚地表明,抗定植是微生物群落的集體屬性。換句話說,一種菌株只有在與其他菌株結合使用時才具有保護作用。”
然而,研究人員發現,細菌群落的特定成員——而不僅僅是整體多樣性——對保護水平有關鍵影響。某些微生物物種被發現對以社區為基礎的保護至關重要,盡管這些物種本身提供的保護很少。

圖2 隨著微生物組多樣性的增加,不同營養素被消耗的可能性增加
研究人員證明,保護性細菌群落通過消耗病原體所需的營養物質來阻止病原體的生長。正如他們在報告中所寫的那樣,“盡管如此復雜,我們發現這些生態模式可以用一個簡單的基本原則來解釋:某些群落消耗營養和阻止病原體生長的集體能力。營養阻斷效應是整個群落的特性,而不是任何一個物種的特性。抗殖民化是一種社區水平的特征,這解釋了我們在實驗中觀察到的生態多樣性和復雜性的重要性。”
通過評估不同細菌物種的基因組,科學家們還發現,最具保護性的群落是由與致病物種具有高度相似蛋白質組成的物種組成的。“我們的基因組分析表明,在編碼功能上與病原體高度重疊的群落提供了最好的定植抗性,”他們評論道。
代謝分析表明,保護物種對碳源的需求與病原體相似。研究小組繼續說:“只有當群落在碳源利用方面與病原體有足夠高的重疊時,才會觀察到定植抗性。此外,與病原體代謝重疊最多的群落提供了最大的定植抗性。”
牛津大學生物和生物化學系的第一作者Frances Spragge評論說:“至關重要的是,盡管微生物組多樣性的增加增加了抵御這些病原體的可能性,但微生物群落和病原體之間營養利用譜的重疊是關鍵。某些在群落保護中起關鍵作用的物種與病原體表現出高度的代謝重疊,因此也有相似的營養需求。”
研究人員利用這種營養阻斷原理來預測細菌群落,這些細菌群落將對抗微生物藥物耐藥性(AMR)的大腸桿菌菌株提供弱保護和強保護。在實驗測試中,與大腸桿菌菌株具有最高營養重疊的群落在減少病原體豐度方面的效果是預計提供弱保護的群落的100倍。他們寫道:“我們運用我們的發現成功地預測了抵抗一種新的目標菌株的群落。”
根據研究人員的說法,這些新的見解可以通過優化腸道微生物群落發展成對抗有害腸道病原體的新策略。這一發現也可以解釋為什么個體在接受抗生素治療后更容易感染肺炎克雷伯菌等物種,因為抗生素治療可以降低腸道微生物群物種的多樣性。
參考資料
[1] Microbiome diversity protects against pathogens by nutrient blocking.



